Жизнь после замены трикуспидального клапана
Обновлено: 03.07.2024

Операция по замене сердечного клапана – это очень сложный, требующий пристального внимания и высокой точности, процесс. К счастью, современная медицина позволяет не только проводить операции на таком важном органе, но и делать это с высокой эффективностью и минимальным риском для пациента. Замена сердечного клапана может потребоваться не только пожилым, но и молодым людям.
Анатомия сердца и причины замены его клапана
В нашем сердце четыре клапана – аортальный, митральный, трикуспидальный и клапан легочной артерии. Они обеспечивают правильное прохождение крови через четыре сердечные камеры в процессе сердцебиения.
Нарушения структуры и, как следствие, функционирования могут возникнуть при рождении, в качестве врожденных дефектов, которые будут сказываться на дальнейшей жизни. Также, разрушение ткани клапанов может стать результатом некоторых болезней, к примеру – ревматической лихорадки или инфекционного эндокардита.
К сожалению, как и весь организм, сердечные клапаны тоже подвержены старению. Вне зависимости от причины, клапан может как ослабнуть (начать пропускать кровь в обратную сторону), так и наоборот – зарубцеваться, стать более жестким. Это приведет к неполному открытию клапана. Неполное, неправильное открытие клапана называется «стеноз». Когда клапан ослаблен или растянут, такое нарушение называется недостаточностью или «регургитацией».
Как проходит операция по замене клапана на открытом сердце
Если вам назначили операцию на одном из сердечных клапанов, то стоит лечь в стационар хотя бы за одни сутки до операции. За это время медицинский персонал проведет все нужные процедуры (КТ, ЭКГ), соберет необходимые анализы. Также, вы успеете познакомиться и побеседовать с вашим врачом. Он расскажет вам все детали предстоящей операции, а также ответит на имеющиеся вопросы.
Волноваться перед операцией на сердце – нормально, поэтому не бойтесь высказывать доктору все свои опасения. Не забудьте в точности описать, какие медикаменты вы принимаете на постоянной основе, это может быть важно.
Примерно за час до операции вам дадут первые обезболивающие. Сама операция проходит под общим наркозом, который гарантирует глубокий сон и отсутствие боли. Как правило, хирургическое вмешательство длится 3-3.5 часа.
Ваши родственники могут находиться в специальном помещении, ожидая вас. Когда операция будет завершена, врач расскажет им о результатах. У всех людей, в зависимости от возраста, массы тела и пола, наркоз проходит через разное время, которое, как правило, ограничивается несколькими часами.
Восстановление после операции на сердце
Когда вы окажетесь дома, постарайтесь скорее вернуться к привычному режиму сна и бодрствования. Желательно находить время на короткий сон после обеда. В течение нескольких недель вам следует регулярно взвешиваться и записывать свою массу. Скорее всего, вы похудели за время пребывания в больнице. Вы будете набирать вес, но обязательно сообщайте своему врачу, если быстро поправляетесь. Ускоренный набор массы может говорить о том, что в организме скапливается жидкость, а это опасно!
В остальном – обычная реабилитация. Если врач позволит – совершайте короткие пешие прогулки, желательно в сопровождении близких или сиделки. Также можете неинтенсивно заниматься на велотренажере. Старайтесь каждый день делать чуть больше, чем вчера. Однако, не переусердствуйте. Если устали – отдохните, если отдохнули – позанимайтесь.
В течение полугода вы будете ощущать улучшение самочувствия почти каждый день. Касательно повседневных дел, вам нельзя поднимать и передвигать предметы, весом более 2.5 кг. Можно заниматься несложной работой по дому, ходить в кино, кафе, посещать общественные мероприятия. Если вы водите машину – можете передвигаться на ней. Будет полезно подниматься по лестнице, однако начинать нужно с малого, желательно – под присмотром близких.
Послеоперационный период
Через 1-2 дня, в зависимости от того, как проходит восстановление, вы сможете садиться на кровати. Потом вставать и передвигаться на небольшие расстояния с чужой помощью. Через несколько дней можно будет помыться, но под контролем медсестры. Как только уберут воздушную трубку, можно будет пить. Возможно, у вас не будет аппетита, но полноценное питание необходимо для скорейшего выздоровления. Врач скажет, когда вы сможете переходить от жидкой пищи к твердой.
С каждым днем вам будет становиться все лучше и лучше, однако, возможна усталость и эмоциональные спады. Это нормальные последствия операции. Когда врач будет полностью уверен, что вы достаточно восстановились, вас выпишут из стационара домой. Желательно, чтобы кто-то из родных вас встретил и отвез. В крайнем случае – такси. Мотаться на общественном транспорте или садиться за руль через неделю после операции на открытом сердце – не лучшая идея. Учтите, что первые дни вам стоит находиться под присмотром близких или сиделки.
Питание и лекарства в период реабилитации после операции на сердце
Во время пребывания в лечебном учреждении, вам предоставят подробную информацию о том, какую диету вам предстоит соблюдать. Если кратко, то питание должно быть здоровым. Скорее всего, вам следует ограничить соль, сахар, стараться уменьшать количество трансжиров и насыщенных жирных кислот.
Кроме того, вам придется изменить медикаментозную терапию. Вы должны принимать только те препараты, которые пропишет ваш врач. Без консультации со специалистом не принимайте медикаменты, которые были до операции. Если вам назначили антикоагулянты, то подходите к этому очень ответственно. Не пропускайте приём, а, если все же не смогли выпить вовремя – проконсультируйтесь с вашим врачом. Не нужно в следующий раз принимать двойную дозу!
Тревожные признаки после операции по замене клапана сердца
В самом деле, операция по замене клапана очень надежна. Проблемы бывают крайне редко, но все же, бывают. Существует ряд признаков, по которым можно понять, что что-то идет не так. Симптомы, указывающие, что следует немедленно обратиться к врачу:
1) Кожа вокруг разреза стала очень теплой, отёкшей, появилась лихорадка.
2) Возникла внезапная тяжелая одышка, не связанная с физической нагрузкой.
3) Не проходящая в течение нескольких дней слабость.
4) Задержка жидкостей, необычно быстрый набор веса, отёк лодыжек.
5) Потеря сознания, даже на короткий промежуток времени.
6) Внезапные тревожные состояния, изменения ритма сердца, ощущения открытия и закрытия клапана.
Успешность и темпы вашего восстановления зависят от многих параметров. Главное – это неукоснительно принимать прописанные врачом препараты, появляться на плановых обследованиях у кардиолога как минимум раз в год, питаться только здоровой пищей. Желательно вести активный образ жизни, чаще гулять, путешествовать. Кроме прочего, строго запрещено курить.
Лечебно-диагностический центр Международного института биологических систем им. С.М. Березина, Санкт-Петербург, Россия
Кафедра сердечно-сосудистой хирургии Уральской государственной медицинской академии, Центр сердца и сосудов ГБУЗ СОКБ №1, Екатеринбург
Уральская государственная медицинская академия, Екатеринбург
Протезирование трикуспидального клапана: результаты 10-летнего наблюдения
Журнал: Кардиология и сердечно-сосудистая хирургия. 2014;7(4): 92-95
Михайлов А. В., Зиятдинов Д. Ж., Идов Э. М. Протезирование трикуспидального клапана: результаты 10-летнего наблюдения. Кардиология и сердечно-сосудистая хирургия. 2014;7(4):92-95.
Лечебно-диагностический центр Международного института биологических систем им. С.М. Березина, Санкт-Петербург, Россия





Проведен анализ результатов протезирования трикуспидального клапана у 186 больных с различной этиологией порока, в том числе в 89,2% случаев протезирование биопротезом. Одноклапанное протезирование выполнено у 43,5% больных, двухклапанная коррекция - у 32,8%, трехклапанная коррекция - у 23,7%. Осложнения наблюдались у 24,4% оперированных больных, летальность составила 13,4%. Отдаленные результаты изучены в 126 (78,3%) случаях. Дисфункция биопротезов выявлена у 8,2% больных, тромбоз механического протеза - у 11,1%. Электрокардиостимулятор был имплантирован в 32,7% случаев, у 41,8% пациентов сохранялась потребность в диуретиках. Потребность в репротезировании трикуспидального клапана возникла у 13,5% пациентов. Смертность в отдаленном периоде составила 12,7%, актуарная 10-летняя выживаемость - 87,3%.
Лечебно-диагностический центр Международного института биологических систем им. С.М. Березина, Санкт-Петербург, Россия
Кафедра сердечно-сосудистой хирургии Уральской государственной медицинской академии, Центр сердца и сосудов ГБУЗ СОКБ №1, Екатеринбург
Уральская государственная медицинская академия, Екатеринбург
Протезирование трикуспидального клапана наряду с пластикой является одним из вариантов хирургического лечения, который применяется при невозможности сохранения клапана, связанной с грубыми изменениями створок и подклапанного аппарата. В отечественной литературе [1, 2] за последние годы имеется небольшое число работ, посвященных изучению отдаленных результатов протезирования трикуспидального клапана. В связи с этим мы решили представить свой опыт по этой проблеме. По данным разных авторов [4-7, 10], при протезировании трикуспидального клапана отмечается высокий уровень осложнений, а летальность остается в пределах 20%.
Материал и методы

С 2000 по 2009 г. в нашем центре выполнено 218 операций протезирования трикуспидального клапана. В настоящей работе проанализированы данные 186 пациентов. Основные характеристики больных представлены в табл. 1. Систолическое давление в легочной артерии, по данным зондирования правых отделов сердца, у половины пациентов превышало 40 мм рт.ст. Большинство пациентов поступали для лечения с тяжелой сердечной недостаточностью, при этом средний функциональный класс по NYHA составил 3,5±0,7. У 51% больных уже имелась персистирующая фибрилляция предсердий. Практически у всех поступивших была кардиомегалия за счет правых отделов сердца. В прошлом перенесли клапанную коррекцию 94 (51%) пациента, из них у 67 (36%) ранее выполнены закрытая митральная комиссуротомия или протезирование митрального клапана. Вмешательство на трикуспидальном клапане прежде перенесли 27 (15%) больных, из них у 13 (7%) возник рецидив трикуспидальной недостаточности после ранее выполненной пластики, а 14 (8%) потребовалось репротезирование трикуспидального клапана в связи с дегенерацией биопротеза.
Все операции выполнялись по стандартной методике. Искусственное кровообращение осуществлялось посредством бикавальной канюляции и канюляции восходящей аорты. До 2005 г. операции выполнялись в условиях умеренной гипотермии (32 °С), в последующем - в условиях нормотермии. Холодовая кровяная кардиоплегия применялась у большинства пациентов, фармакохолодовая кардиоплегия раствором Кустодиол - у 9 (4,8%). Продолжительность искусственного кровообращения и время пережатия аорты составили 118,9±48,8 и 93,8±41,8 мин соответственно.
Изолированное протезирование трикуспидального клапана выполнено 43,5% пациентов, остальные перенесли двухклапанную (32,8%) и трехклапанную (23,7%) коррекции. Причем большинству выполнено митрально-трикуспидальное (52 случая) и митрально-аортально-трикуспидальное протезирование - 41 (50%). Протезирование трикуспидального клапана механическим протезом Мединж-2 было выполнено 19 больным. До 2006 г. в основном использовались ксенопротезы КемКор (82 случаев), с 2006 г., как правило, стали имплантироваться перикардиальные протезы Перикор (68); 9 пациентам имплантированы протезы Perimount («Carpentier-Edwards Inc.»), 8 - протезы Био-Лаб.
Результаты
В 37,6% случаев пациентам понадобилась продленная (более 24 ч) искусственная вентиляция легких, в 38,7% - длительное (более 48 ч) пребывание в отделении реанимации, в 72% - инотропная поддержка различной длительности. В раннем послеоперационном периоде 24,4% больных перенесли различные осложнения. Наиболее часто встречались атриовентрикулярная блокада III степени (9,1%), экссудативный перикардит (4,8%), инфекционные осложнения (4,9%) и послеоперационное кровотечение (3,8%). Неврологические нарушения зафиксированы у 1,6% пациентов. Летальность составила 13,4%. Основными причинами смерти были прогрессирующая сердечно-сосудистая недостаточность (7%) и полиорганная недостаточность (2,8%). Среди остальных причин - желудочно-кишечное кровотечение (1,2%), острая дыхательная недостаточность, острое нарушение мозгового кровообращения, послеоперационное кровотечение и распространенный перитонит (по 0,6% каждое). Прогностическими факторами, ассоциирующихся с летальностью, явились ревматический генез трикуспидального порока (р=0,017) и исходный функциональный класс по NYHA (р=0,03).

Отдаленные результаты изучены у 126 пациентов в сроки от 13 до 130 мес (медиана - 43 мес). Динамика основных эхокардиографических параметров представлена в табл. 2.

После операции у пациентов уменьшились размеры правых отделов сердца (с 71,7±17,2 до 60,0±10,6 мм, р<0,001) и размер правого желудочка (с 38,7±7,0 до 34,7±6,2 мм, р<0,001). Значительно снизился функциональный класс сердечной недостаточности (с 3,5 до 2,4, р<0,001). Потребность в имплантации постоянного кардиостимулятора возникла у 32,7% наблюдавшихся. У 41,8% сохранялась потребность в диуретиках, большинство из них были пациенты с многоклапанной коррекцией. На механических протезах, в отличие от биологических, отмечался более выраженный пиковый градиент (11,1±4,8 мм рт.ст. против 8,1±3,8 мм рт.ст., р=0,006). Дисфункция биопротезов выявлена у 8,2% пациентов в сроки от 50 до 117 мес после операции (медиана - 71 мес). Тромбоз механического протеза обнаружен у 10,5% пациентов (медиана срока наблюдения - 16 мес). Потребность в репротезировании трикуспидального клапана возникла у 13,5% пациентов. Смертность в отдаленном периоде составила 12,7%. У большинства больных (81,3%) причины смерти были связаны с кардиальной патологией. На рисунке представлена актуарная кривая 10-летней выживаемости, составившей через 10 лет 87,3% (95% ДИ 81,5-93,1). Рисунок 1. Актуарная кривая 10-летней выживаемости после протезирования трикуспидального клапана.
В наше исследование вошла гетерогенная группа пациентов, которым потребовалось протезирование трикуспидального клапана. Преобладал ревматический генез порока. Выбор в сторону замены, а не пластики клапана, как правило, диктовался не столько этиологической сущностью порока, сколько выраженностью органических изменений клапана. Это были пациенты с сердечной недостаточностью III-IV функционального класса. У пациентов с ревматизмом было наибольшее количество двух- и трехклапанных коррекций. О тяжести исходного состояния больных свидетельствовал и тот факт, что более чем у ⅓ пациентов возникла необходимость в продленной искусственной вентиляции легких и длительном пребывании в отделении реанимации. Имплантация постоянного водителя ритма потребовалась 32,7% пациентов в связи с острой послеоперационной блокадой III степени или развитием в отдаленном периоде атриовентрикулярной блокады высокой градации и синдрома слабости синусового узла. Таким образом, суммарно у 57,1% больных наблюдали разные осложнения. Некоторые авторы [8] приводят более низкую частоту потребности в имплантации водителя ритма. Другие авторы [4, 6, 7] представляют примерно похожие данные. Более того, F. Filsoufi и соавт. [5] при лечении 81 пациента те или иные осложнения наблюдали во всех случаях.
Среди факторов, связанных с летальностью, в нашем исследовании отмечен ревматический генез порока трикуспидального клапана, что, вероятно, объясняется несколькими факторами. Во-первых, это длительное течение заболевания и, как итог, более выраженная сердечная недостаточность. Во-вторых, частое сочетание ревматического трикуспидального порока с митральным или аортальным и, соответственно, сочетанный характер операции. Несмотря на это, в нашем наблюдении отмечено улучшение эхокардиографических параметров и снижение тяжести сердечной недостаточности, которая у большинства пациентов соответствовала II функциональному классу по NYHA.
Исходная тяжесть сердечной недостаточности также является прогностическим фактором неблагоприятного исхода операции. Похожие данные представлены Y. Topilsky и соавт. [9].
Р.М. Муратов и соавт. [3] отметили более раннее возникновение дисфункции биопротезов при сохранении подклапанного аппарата трикуспидального клапана.
В нашем исследовании такой закономерности не выявлено. Также нами не было обнаружено различий потребности в репротезировании между различными типами биопротезов (р=0,37). Среди хирургов нет полного согласия относительно приоритета в выборе типа протеза. Ряд исследователей 13 не отмечают преимуществ биопротезов над механическими в трикуспидальной позиции.
В других исследованиях [1, 4, 14], напротив, рекомендуют использовать в трикуспидальной позиции именно биопротезы.
Наше исследование имеет ряд ограничений и недостатков. Во-первых, это ретроспективное исследование, и делать какие-либо выводы относительно преимущества биологических или механических протезов, не представляется возможным. Во-вторых, представленная популяция неоднородна по этиологии порока, что также оказывает большое влияние на отдаленные результаты. В-третьих, отдаленные результаты удалось изучить не у всех больных.
Выводы
1. Пациенты, подвергающиеся протезированию трикуспидального клапана, составляют группу высокого риска.
2. Протезирование трикуспидального клапана при его органических изменениях является оптимальным методом хирургического лечения, хотя и сопровождается повышенным уровнем летальности и осложнений.
3. Развитие дисфункции (тромбоза) механических протезов в трикуспидальной позиции происходит в более ранние сроки в сравнении с биологическими протезами, что требует дальнейшего изучения отдаленных результатов использования механических протезов.
Первый МГМУ им. И.М. Сеченова; Московский НИИ педиатрии и детской хирургии
Отделение кардиохирургии клиники аортальной и сердечно-сосудистой хирургии Первого МГМУ им. И.М. Сеченова
Кафедра сердечно-сосудистой хирургии и инвазивной кардиологии Первого МГМУ им. И.М. Сеченова (зав. — д.м.н. Р.Н. Комаров), Российский научный центр хирургии им. акад. Б.В. Петровского (дир. — акад. РАН Ю.В. Белов), Москва, Россия
Российский центр хирургии им. акад. Б.В. Петровского, Москва, Россия
РНЦХ им. акад. Б.В. Петровского РАМН
Репротезирование трикуспидального клапана у больной с ранее имплантированным ЭКС
Журнал: Кардиология и сердечно-сосудистая хирургия. 2019;12(2): 152-155
Первый МГМУ им. И.М. Сеченова; Московский НИИ педиатрии и детской хирургии





Ежегодная заболеваемость ИЭ составляет 30—100 случаев на 1 млн населения, при этом правые отделы сердца поражаются лишь в 10—15% случаев, преимущественно у лиц, употребляющих наркотики с помощью внутривенных инъекций. В статье представлен клинический пример дисфункции биопротеза ТК у больной с имплантированным ЭКС.
Первый МГМУ им. И.М. Сеченова; Московский НИИ педиатрии и детской хирургии
Отделение кардиохирургии клиники аортальной и сердечно-сосудистой хирургии Первого МГМУ им. И.М. Сеченова
Кафедра сердечно-сосудистой хирургии и инвазивной кардиологии Первого МГМУ им. И.М. Сеченова (зав. — д.м.н. Р.Н. Комаров), Российский научный центр хирургии им. акад. Б.В. Петровского (дир. — акад. РАН Ю.В. Белов), Москва, Россия
Российский центр хирургии им. акад. Б.В. Петровского, Москва, Россия
РНЦХ им. акад. Б.В. Петровского РАМН
Инфекционный эндокардит (ИЭ) — тяжелое, воспалительное заболевание эндокарда с преимущественным поражением клапанов сердца, вызванное различными патогенными микроорганизмами или грибами. Патология может сопровождаться тромбоэмболиями в различные артериальные бассейны, а также системным поражением сосудов, внутренних органов и выраженной интоксикацией.
Инфекционный эндокардит наиболее часто встречается у лиц в возрасте 20—50 лет, в 2 раза чаще у мужчин, чем у женщин. Ежегодная заболеваемость ИЭ составляет 30—100 случаев на 1 млн населения, при этом правые отделы сердца поражаются лишь в 10—15% случаев, преимущественно у лиц, употребляющих наркотики с помощью внутривенных инъекций [1].
В настоящее время для диагностики ИЭ используются DUKE-критерии, утвержденные в 1994 г. службой эндокардита Университета Duke [1].
Большими клиническими DUKE-критериями ИЭ являются:
1. Положительная гемокультура из двух раздельных проб крови типичных микроорганизмов (St. viridans, St. bovis, бактерии группы HACEK (Haemophilus spp., Actinobacillus spp., Cardiobacterium spp., Eikenella spp., Kingella spp.), S. аureus или внебольничные штаммы Enterococcus). Серологические методики и ПЦР-исследования эффективны при диагностике ИЭ, вызванного труднокультивируемыми микроорганизмами: Bartonella, Legionella, Chlamydia, Coxiella burnetti и Tropheryma.
2. Признаки поражения эндокарда — положительные эхокардиографические признаки ИЭ (вегетации на клапанах сердца или подклапанных структурах по ходу струи регургитации, на имплантированных материалах (сосудистых протезах, протезах клапанов сердца, опорных кольцах, неохордах и т. д.), абсцесс или дисфункция протезированного клапана), клапанная недостаточность de novo (изменение ранее существовавшей степени регургитации).
Малыми критериями диагностики ИЭ являются:
1. Предрасполагающие факторы (искусственный клапан, внутривенное введение наркотиков и др.).
2. Лихорадка >38 °C.
3. Сосудистые поражения и их признаки: эмболии крупных артерий, септические инфаркты легкого, микотические аневризмы, внутримозговые кровоизлияния, геморрагии на переходной складке конъюнктивы.
4. Иммунологические феномены: гломерулонефрит, узелки Ослера, пятна Рота и т. д.
5. Положительный посев крови, не отвечающий основным критериям.
Для постановки диагноза ИЭ необходимы 2 больших критерия, 1 большой и 3 малых критерия или 5 малых критериев.
Несмотря на успехи в области разработки высокоэффективных антибиотиков, радикальное хирургическое лечение, включающее удаление очага инфекции и нормализацию внутрисердечной гемодинамики, является самым эффективным и, как следствие, основным методом лечения ИЭ.
Ведущим предрасполагающим фактором развития ИЭ трикуспидального клапана (ТК) считается инъекционная наркомания. Помимо этого, длительная катетеризация центральных вен, использование имплантируемых устройств, таких как электрокардиостимуляторы и дефибрилляторы, также увеличивают риск инфекционного поражения ТК.
Представляем клинический пример дисфункции биопротеза ТК у больной с имплантированным ЭКС.
Пациентка С., 36 лет, 18.09.18 поступила в кардиохирургическое отделение с жалобами на одышку при физической нагрузке (подъем на 2 этаж), отеки на нижних конечностях, перебои в работе сердца.
Из анамнеза известно, что в 2006 г. перенесла ИЭ ТК на фоне внутривенного употребления наркотических веществ. Была госпитализирована с клиникой декомпенсации кровообращения (асцит, гидроторакс). На фоне антибактериальной, кардиальной терапии отмечена положительная динамика, оперативное лечение не предлагалось ввиду продолжения внутривенного приема наркотиков. В 2014 г. появились одышка и сухой кашель, после чего пациентка прекратила прием внутривенных наркотических препаратов и прошла курс антибактериальной терапии. При обследовании были выявлены порок ТК, недостаточность ТК 4-й стадии. В 2015 г. выполнено протезирование ТК биологическим протезом Биолаб 28 мм. В послеоперационном периоде развилась преходящая полная АВ-блокада без гемодинамически значимых пауз. С 2016 г. возникли синкопальные состояния (эпизоды Морганьи—Адамса—Стокса), при суточном мониторинге ЭКГ зафиксирована пауза до 4,0 с, по поводу чего был имплантирован ЭКС Esprit SR, приступы более не рецидивировали.
С 2017 г. больная отметила усиление одышки, появление отеков на нижних конечностях на фоне диуретической терапии (торасемид 20 мг/сут, фуросемид до 60 мг через день). По данным ЭхоКГ: механическое ограничение подвижности створки биопротеза ТК электродом ЭКС. Дисфункция протеза Т.К. Гемодинамический стеноз отверстия протеза Т.К. Выраженная транспротезная регургитация 3—4-й степени. Дилатация правых камер сердца, снижение сократительной функции левого желудка. Митральная недостаточность (МН) 1-й степени.
Данные инструментальных методов обследования
ЭКГ: синусовый ритм с ЧСС 90 уд/мин. Отклонение электрической оси сердца вправо. Нарушение внутрижелудочковой проводимости. АВ — блокада II стадии, Мобитц 2. Единичные предсердные экстрасистолы. Гипертрофия обоих предсердий. Изменения миокарда левого желудочка.
ЭхоКГ: конечный диастолический размер ЛЖ 4,3 см, конечный систолический размер ЛЖ 3,0 см, толщина межжелудочковой перегородки 0,9 см, толщина задней стенки ЛЖ 1,1 см, конечный диастолический объем 80 мл, конечный систолический объем 33 мл, ударный объем 47 мл, фракция выброса 58,75%, сердечный выброс 3,15 л/мин. Локальная сократимость не нарушена. Диастолическая функция левого желудочка не нарушена. Правый желудочек (ПЖ) 2,7 см, левое предсердие 3,9×4,7 см, объем 46 мл. Правое предсердие 5,2×6,1 см, объем 134 мл. МН 1-й степени. ТК: протез ТК, максимальная скорость кровотока 1,6 м/с, максимальный и средний градиенты давления 11 и 7 мм рт.ст. соответственно, трикуспидальная регургитация 4-й степени, систолическое давление в легочной артерии 27 мм рт.ст.
Консультация аритмолога: ЭКС работает в режиме VVI с базовой частотой 60 уд. в минуту. При усугублении АВ-блокады в послеоперационном периоде вплоть до 3-й степени показана имплантация постоянного двухкамерного ЭКС.
20.09.19 выполнено репротезирование ТК биологическим протезом St. Jude Epic-27, удаление правожелудочкового электрода в условиях ИК и кровяной кардиоплегии. Рестернотомия. Вскрыт перикард. Правые отделы сердца (значительно увеличены в размерах) и восходящая аорта мобилизованы от спаек. Канюляция восходящей аорты, верхней полой вены и нижней полой вены, начало ИК, наложены турникеты на полые вены, аорта пережата с последующей антеградной кровяной кардиоплегией. Правая атриотомия. В позиции ТК — ранее имплантированный биопротез с проходящим в его отверстии электродом ЭКС. Две из трех створок биопротеза, между которыми располагался электрод ЭКС с подвернутым краем, фиброзированы, ригидны, сросшиеся в области комиссуры (рис. 1). Рис. 1. Интраоперационное фото биопротеза в трикуспидальной позиции. Отмечен некоторый оверсайзинг протеза относительно фиброзного кольца (ФК) ТК, сращение створок протеза со стенками ПЖ и частичный тромбоз пространства непосредственно под створками. Электрод удален из ПЖ, отсечен на уровне верхней полой вены. Протез Т.К. удален (рис. 2). Рис. 2. Вид удаленного биопротеза. В трикуспидальную позицию имплантирован биологический протез St. Jude Epic 27 мм на 14 П-образных швах нитью Этибонд 2,0 на тефлоновых прокладках. Ушивание правого предсердия. Стандартное завершение операции. Время И.К. 81 мин, аноксия миокарда 67 мин.
Послеоперационный период без особенностей. Регистрировался синусовый ритм. Максимальный и средний градиенты давления на протезе составили 8,0 и 4,0 мм рт.ст. соответственно.
Пациентка в удовлетворительном состоянии была выписана на 7-е сутки после операции.
Через 2 мес после операции самочувствие пациентки хорошее, эпизодов гипертермии и нарушений ритма не было, консультирована аритмологом — рекомендовано удаление ЭКС и электрода из ВПВ, что было выполнено через 3 мес после операции без осложнений.
Пациентка ведет активный образ жизни, мочегонные препараты не принимает, жалоб нет, гемодинамические показатели внутрисердечной гемодинамики и на протезе ТК в пределах нормы.
На сегодняшний день недостаточность кровообращения IIА—IIБ стадии, выраженная кардиомегалия, наличие протез-зависимых осложнений являются показаниями к репротезированию ТК [2].
Согласно данным литературы [3—7], пластика ТК возможна в большинстве случаев даже при обширной деструкции клапана. Реконструкция возможна с применением заплат из аутоперикарда для восстановления створок, аннулопластики с формированием неохорд из политетрафторэтилена. Вопреки предположению, что при ИЭ следует избегать имплантации опорных колец (особенно у инъекционных наркоманов), риск реинфекции синтетических элементов достаточно низок. M. Dawood и соавт. [3] сообщили об отсутствии реинфекции в группе ринговой аннулопластики, несмотря на высокую встречаемость в выборке пациентов, продолжающих прием внутривенных наркотиков. При этом 21% пациентов после протезирования ТК нуждались в повторной операции в отдаленном периоде по поводу ИЭ протезированного клапана. Шовная аннулопластика может сопровождаться увеличением риска рецидива трикуспидальной недостаточности и аннулодилатации.
Нарушение ритма и проводимости является серьезной проблемой при хирургических вмешательствах на Т.К. Риск этого осложнения выше в случае протезирования ТК по сравнению с его пластикой. Согласно регистру американской ассоциации торакальных хирургов, включающему 910 вмешательств на ТК по поводу ИЭ, протезирование ТК достоверно чаще приводит к блокадам АВ-проведения (16%) по сравнению с пластикой ТК (3%) (р<0,0001) [8].
Установка постоянных эндокардиальных электродов через биопротез ТК или створки нативного клапана может приводить к значимой трикуспидальной регургитации и сокращению срока нормального функционирования клапана ввиду фиброза его створок. Выраженная трикуспидальная регургитация (3—4-й степени) встречается у 25—29% пациентов с имплантированными ЭКС [9].
Учитывая вышесказанное, необходимо тщательно определять показания к установке постоянного кардиостимулятора с трансклапанным проведением электродов у больных после вмешательств на ТК, так как такое «сочетание» значительно ухудшает функцию трикуспидального протеза и увеличивает риск повторной операции. В приведенном клиническом примере больной был имплантирован ЭКС по поводу синдрома Морганьи—Адамса—Стокса, в пользу которого имелись лишь анамнестические указания с отсутствием клинической картины значимой АВ-блокады в настоящий момент времени и зафиксированной одиночной паузой до 4,0 с в ночное время.
Альтернативой может быть использование эпикардиальных электродов, фиксируемых интраоперационно или из правосторонней торакотомии. При использовании этих устройств отсутствует риск повреждения протеза клапана или нативного клапана, а также для них характерен низкий риск инфицирования при ИЭ Т.К. Возможность установки эпикардиальных электродов необходимо рассматривать при имеющихся значимых нарушениях ритма и проводимости до операции или при наличии достаточно обоснованных предположений об интраоперационном повреждении проводящей системы или в раннем послеоперационном периоде (до 12—14-х суток).
В нашем случае интраоперационно было отмечено некоторое превышение необходимого размера имплантированного протеза Т.К. Превышение посадочного диаметра протеза приводит к нарушению пространственной геометрии и подклапанной гемодинамики. В результате нарушается функционирование створок протеза и касание ими стенок желудочка, что со временем привело к фиброзу и тромбозу подклапанного пространства с фиксацией створок к желудочковой поверхности и выраженной недостаточности ввиду ограничения подвижности створок. Кроме того, изменение нормальных пространственных соотношений в полости правого желудочка может приводить к увеличению напряжения сдвига, что способствует прогрессирующему повреждению створок [5].
Таким образом, как первичные, так и повторные вмешательства на ТК могут быть выполнены с низкой частотой осложнений и высокой отдаленной выживаемостью даже у пациентов с анамнезом внутривенной наркомании. Однако, учитывая определенный риск послеоперационных нарушений ритма и необходимости в имплантации ЭКС, важны взвешенный подход, безошибочная хирургия (быстрота—простота—качество) и тщательное соблюдение послеоперационных протоколов ведения больного.
Результаты исследования. Среди пациентов, которым выполнили пластическую коррекцию трикуспидального порока, у 28 (41%) использовали опорное кольцо «МедИнж» (рис. 1). Размер опорного кольца варьировался от 28 до 36 (32±2) мм и подбирался исходя их конституциональных особенностей, размеров полостей правых предсердия и желудочка, давления в легочной артерии и выраженности дилатации фиброзного кольца. Основным показанием к применению опорной конструкции было увеличение большой оси фиброзного кольца клапана более 50 мм. В таблице 1 представлены до и интраоперационные характеристики пациентов в зависимости от выбранного метода пластики.
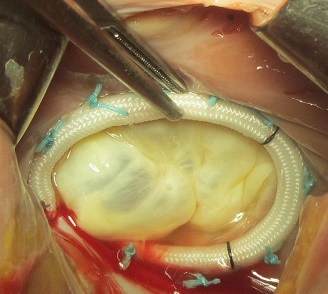
Рис. 1. Опорное кольцо в трикуспидальной позиции.
Таблица 1. До и интраоперационные характеристики пациентов, которым выполнили аннулопластику трикуспидального клапана.

Имплантация опорного кольца требует бóльших временных затрат, но является, на наш взгляд, оправданной процедурой в тех случаях, когда шовная аннулопластика уже доказала свою неэффективность – в 16 случаях непосредственной причиной возврата трикуспидальной регургитации явилось прорезывание нити через фиброзное кольцо. При дилатации фиброзного кольца в пределах 5,2±0,6 см мы старались выполнить шовную аннулопластику при условии, что на первичной операции не проводилось вмешательств на трехстворчатом клапане, либо не было признаков прорезывания ранее проведенной нити. Стоит отметить, что пациенты, которым имплантировали опорную конструкцию, имели не только более выраженную дилатацию фиброзного кольца, но и более высокий уровень систолического давления в легочной артерии (58±11 против 50±8), что также служило основанием для применения опорного кольца. В одном случае мы определили расщепление передней створки трикуспидального клапана как ведущую причину развития трикуспидальной недостаточности. Пациенту была успешно выполнена пликация передней створки и имплантация опорного кольца.
Особый интерес представляет дисфункция биологического протеза в трикуспидальной позиции. В доступной литературе крайне мало информации о нюансах проведения операции репротезирования трикуспидального клапана. Частично это можно объяснить небольшим количеством подобных операций – в клинике нашего Института, например, из 345 имплантаций ксенопротезов в трикуспидальную позицию, в отдаленном периоде репротезировали только 12, т.е. 3,5% от общего количества. Тем не менее, обладая даже небольшим опытом подобных операций, мы можем сделать определенные выводы, которые будут интересны кардиохирургам. Основной особенностью при эксплантации биопротеза из трикуспидальной позиции было сращение ранее сохраненной септальной створки или (в одном случае) целого клапана с биологическим протезом. В двух наблюдениях результатом такого сращения стало разрастание фиброзной ткани с переходом на внутреннюю часть ксеноклапана и созданием значительного ограничения подвижности ксеностворок. Этот процесс стал причиной развития дисфункции и необходимости репротезирования клапана. В двух наблюдениях формирование тесной связи между нативным и искусственным клапанами не приводило непосредственно к развитию дисфункции, однако значительно затрудняло эксплантацию протеза.
В настоящее время мы предпочитаем выполнять полное иссечение трикуспидального клапана и подклапанных структур до головок папиллярных мышц, оставляя лишь бортик ткани 3-4 мм, достаточный для более надежной фиксации протеза. В двух случаях мы наблюдали перфорацию створки ксенопротеза ранее проведенным эндокардиальным электродом. Всего же у 5 из 12 больных, реоперированных по поводу дисфункции трикуспидального протеза, в правых отделах находились один или более эндокардиальных электродов. Всем пациентам выполнили максимально возможное удаление электродов из правых отделов и системы верхней полой вены с последующей имплантацией ЭКС в миокардиальном варианте. Во всех 12 случаях дисфункция ксенопротеза в трикуспидальной позиции определена как структурная, т.е. сопровождающаяся макроскопическими изменениями створок (рис. 2).
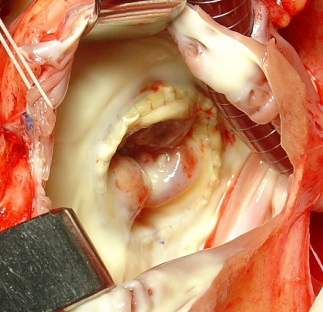
Рис. 2. Структурная дисфункция биологического протеза в трикуспидальной позиции.
Сравнивая уровни послеоперационной летальности после выполнения реконструктивного вмешательства и репротезирования трикуспидального клапана, можно констатировать, что аннулопластические процедуры демонстрируют меньший риск смерти на госпитальном этапе. В группе больных, которым выполнили пластику трикуспидального клапана, летальность составила 3% (2 пациента). Среди пациентов, которым выполнили репротезирование трикуспидального клапана, умерли 3 больных (25%), однако стоит учитывать, что один больной этой группы подвергся эксплантации двух протезов (митрального и трикуспидального), а у одного смерть после операции наступила на фоне острой остановки дыхания вследствие самостоятельного введения неочищенных наркотических средств. Выжившие больные обеих групп к моменту выписки отмечали улучшение общего самочувствия, уменьшение отеков, одышки. В группе пациентов, которым выполнили аннулопластику клапана, нарушения ритма сердца (инцизионное трепетание предсердий) при исходном синусовом ритме наблюдали у 6 (9%) больных. Во всех случаях синусовый ритм был восстановлен электродефибрилляцией сердца. Развитие синдрома Фредерика, требующего имплантации постоянного электрокардиостимулятора, зафиксировали у 2 (3%) пациентов. Среди больных, которым выполняли репротезирование клапана, трепетание предсердий развилось у 1 (8%) пациента. Нарушений проводимости, требующих имплантации постоянного кардиостимулятора, не зафиксировано, но стоит отметить, что изначально 5 (42%) больных поступили в клинику Института с уже имплантированным кардиостимулятором. По данным контрольной эхокардиографии, наиболее значимые изменения наблюдались в динамике полости правого предсердия – уменьшение продольного размера в общей группе с 7,4±1,1 до 6,1±1 см (р=0,02) и уровня легочной гипертензии – с 56±10 до 47±8 мм рт. ст. (р=0,03). Уменьшение давления в легочной артерии, большинстве случаев (75 больных), было связано не только с восстановлением замыкательной функции трикуспидального клапана, но и с коррекцией митрального порока.
Заключение. В отсутствии выраженных морфологических изменений структур трикуспидального клапана при повторном открытом вмешательстве на сердце, предпочтительно выполнение клапансохраняющей процедуры. При дилатации фиброзного кольца по большой оси не более 5,2±0,6 см рекомендовано проведение шовной аннулопластики, более 5,2±0,6 см – имплантация опорного кольца. Нецелесообразно выполнять шовную реконструкцию при формировании дисфункции правого атриовентрикулярного клапана за счет прорезывания нити предыдущей пластики. После восстановления замыкательной функции правого атриовентрикулярного клапана можно ожидать уменьшения размеров правого предсердия и снижения уровня давления в легочной артерии уже в раннем послеоперационном периоде. Вероятность формирования дисфункции ксенопротеза в трикуспидальной позиции за счет формирования сращений структур собственного клапана с корпусом биологической конструкции, свидетельствует о необходимости полного иссечения трехстворчатого клапана при его первичном протезировании.
Список использованных источников:
1. McCarthy P.M., Sales V.L. Evolving indications for tricuspid valve surgery// Curr. Treat. Options Cardiovasc. Med. – 2010. – 12. – P. 587–597.
2. Antunes M.J., Barlow J.B. Management of tricuspid valve regurgitation// Heart. – 2007. – V. 93. – P. 271–276.
3. Li Z.H., Guo Z.P., Liu X.C. et al. Surgical treatment of tricuspid regurgitation after mitral valve surgery: a retrospective study in China// J. Cardiothorac. Surg. – 2012. – V. 7. – 30.
4. Porter A., Shapira Y., Wurzel M. et al. Tricuspid regurgitation late after mitral valve replacement: clinical and echocardiographic evaluation// J. Heart Valve Dis. 1999. V. 8. – P. 57-62.
5. Mestres C.A., Fita G., Parra V.M. et al. Tricuspid valve surgery// HSR Proc. Intensive Care Cardiovasc Anesth. – 2012. – V. 4. – 4. – P. 261–267.
6. De Vega N.G. Selective, adjustable and permanent annuloplasty. An original technic for the treatment of tricuspid insufficiency// Rev. Esp. Cardiol. – 1972. – V. 25. – P. 555-556.
7. Cabrol C. Valvular annuloplasty. A new method// Nouv. Presse Med. – 1972. – V. 1. – P. 1366.
8. Revuelta J.M., Garcia Rinaldi R. Segmental tricuspid annuloplasty: a new technique// J. Thorac. Cardiovasc. Surg. – 1989. – V. 97. – P. 799-801.
9. Blackstone E.H., Navia J.L., Nowicki E.R. et al. Surgical management of secondary tricuspid valve regurgitation: annulus, commissure, or leaflet procedure?// J. Thorac.Cardiovasc. Surg. – 2010. – V. 139. – P. 1473-1482.
10. Tang G.H., David T.E., Singh S.K. et al. Tricuspid valve repair with an annuloplasty ring results in improved long-term outcomes// Circulation. – 2006. – V. 114. – P. 577-581.
11. Астапов Д.А., Караськов А.М., Семенов И.И. и др. Протезирование митрального клапана биологическими протезами «КемКор» и «ПериКор»: отдаленные результаты// Патология кровообращения и кардиохирургия. – 2010. – №4. – С. 23–28.
12. Караськов А.М., Астапов Д.А., Железнев С.И. и др. Биологические протезы «КемКор» и «ПериКор» в атриовентрикулярных позициях сердца// Медицина и образование в Сибири. – 2012. – №2. – С. 66.
14. Maluf M.A., Carvalho A.C., Carvalho W.B. Use of right ventricular remodeling surgery with a porcine pulmonary prosthesis for congenital heart disease// Heart Surg. Forum. – 2011. – V. 14. – 1. – P. 40-50.
Первые часы после операции на сердце
Обычно, после операции на сердце, человек проводит в стационаре около недели. Все это время вы будете находиться в отделении реанимации и интенсивной терапии (ОРИТ). Родственников пустят к вам в палату примерно через 60 минут после операции. Последующие визиты можно будет устраивать в соответствии с правилами лечебного учреждения.
Когда вы очнетесь, к вам будет подключено множество трубок, катетеров и электродов. В частности, у вас во рту будет дыхательная трубка, которая будет мешать вам разговаривать. Не беспокойтесь, рядом будет находиться медсестра, которая поймет, что вам нужно.
Дыхательную трубку уберут через пару часов после операции. Также, к рукам или шее будут подведены тоненькие трубочки, по ним в ваш организм будут вводиться лекарства и питательные вещества. Эти трубки нужны для взятия проб крови и контроля за вашим артериальным давлением. Из груди могут торчать тонкие проводки. Они присоединены к сердцу и, при необходимости, позволяют быстро подключить временный кардиостимулятор. Еще, из вашей груди будут выходить несколько трубок, которые откачивают из окружающих сердце тканей жидкость. Трубка в мочевом пузыре необходима для выведения мочи, а различные электроды, приклеенные к груди – для мониторинга ритма сердца.
После операции вы можете ощущать дискомфорт и болезненность мышц грудной клетки в том месте, где сделан разрез. Не беспокойтесь, рана зашита надежно, никакой опасности нет. В течение первых дней вам будут давать обезболивающие. По мере выздоровления, необходимость в них пропадет.
Читайте также:

