Кефалогематома 1 2 степени у новорожденного и его последствия в дальнейшем
Обновлено: 04.07.2024
В последние десятилетия, в связи с достижениями новейших медицинских технологий (экстракорпоральное оплодотворение, пролонгирование патологической беременности, реанимация новорожденных), особую актуальность приобрела проблема повышения качества жизни де
В последние десятилетия, в связи с достижениями новейших медицинских технологий (экстракорпоральное оплодотворение, пролонгирование патологической беременности, реанимация новорожденных), особую актуальность приобрела проблема повышения качества жизни детей с перинатальной патологией нервной системы [1, 2, 3]. Существенные нарушения: вначале постнатальной адаптации, затем снижение возможности усвоения социального опыта и, как следствие, социальная дезадаптация ребенка — возникают у большинства детей с тяжелыми поражениями нервной системы. По данным ведущих неврологов [3], эти поражения обусловливают основную часть причин детской инвалидности. Кроме того, у детей с нетяжелыми формами перинатальной патологии в последующие годы нередко отмечаются проявления минимальных церебральных дисфункций, существенно затрудняющих их обучение и образование [2]. Поэтому проблемы своевременного лечения и адекватной реабилитации детей с перинатальными поражениями привлекают пристальное внимание врачей различных специальностей: педиатров, неврологов, ортопедов, реабилитологов и др., — а также специалистов по коррекционной педагогике.
Основные методологические принципы реабилитации детей при перинатальной патологии ЦНС, разработанные за последние 10–12 лет [4], могут также лежать в основе терапии этих состояний, задачи которой как в остром периоде, так и в ходе реабилитации, вторичной профилактики отсроченных проявлений заболевания по сути одни и те же. Тем не менее некоторые неврологи понимают под реабилитацией в детском возрасте абилитацию, т. е. создание возможностей для поступательного развития ребенка и коррекцию постепенно выявляющихся отклонений в развитии [3]. С учетом этого общая методология лечения и реабилитации при перинатальном поражении мозга базируется на следующих принципах.
- Раннее начало коррекции. Оптимально опережающее (антенатальное, интранатальное, раннее постнатальное) лечение.
- Индивидуализация лечебно-реабилитационных воздействий — учет характера и степени тяжести основной и сопутствующей патологии, степени зрелости ребенка (гестационный и постконцептуальный возраст), индивидуальных конституционально-генетических характеристик. Применение протоколов (формуляров) ведения новорожденных не противоречит индивидуальному подходу. Использование «индивидуального потенциала компенсаций» [3].
- Подход к больному ребенку с позиций целостности организма, что предполагает коррекцию не только и не столько неврологических расстройств, сколько нейросоматических нарушений [3, 5].
- Комплексное использование различных средств лечения и реабилитации (фармакопрепараты, физические факторы, эстетопсихотерапия и кондуктивная педагогика).
- Этапность и преемственность при проведении реабилитации пострадавших детей, коллегиальность при назначении терапевтических схем и оценке их эффективности.
- Гуманизация диагностических и лечебно-реабилитационных процедур: в последние годы установлена крайне негативная патофизиологическая роль боли у новорожденных детей [4, 6].
- Оздоровление окружающей среды («терапия среды») и тесное взаимодействие медиков с семьей больного ребенка на всех этапах лечения и реабилитации [3, 4].
На каждом из этапов оказания помощи больному новорожденному и грудному ребенку существуют свои ведущие задачи. Так, на первом этапе — в родильном зале, палате интенсивной терапии и отделении реанимации новорожденных — в соответствии с приказом МЗ РФ № 372 от 1995 г. прежде всего решаются задачи компенсации системных нарушений жизненно важных функций — дыхания, кровообращения, выделительной функции почек, энергетического баланса и общего метаболизма.
Медикаментозно-инструментальная терапия предполагает на этом этапе в первую очередь коррекцию кислотно-основного состояния, гипер- или гипогликемии, гиповолемии, артериальной гипотензии или гипертензии, сердечного выброса. По показаниям, с учетом данных мониторирования и лабораторных анализов, применяются осмотические и петлевые диуретики, антигеморрагические, противосудорожные средства (препарат первого выбора — фенобарбитал в стандартной дозе до 20 мг/кг массы тела в сутки). Применение на этом этапе антиоксидантов и ноотрофов (церебропротекторов — пирацетам, эссенциале, ГОМК) не всегда обосновано. Особая осторожность необходима при назначении вазоактивных препаратов: так, некоторые специалисты рекомендуют с 4-го дня жизни инстенон [3], тогда как другие говорят о возможных побочных действиях сосудистых средств [5]. Адекватное лечение в раннем неонатальном периоде (при создании максимально щадящих условий для ребенка и температурного комфорта) способствует адаптационным процессам саногенетической направленности и является основой последующей реабилитации.
Новорожденные не только с тяжелыми, но и со среднетяжелыми проявлениями перинатальной патологии ЦНС переводятся, как правило, в отделение «второго этапа» (отделение патологии новорожденных, отделение для недоношенных детей). Задачи этого этапа — дальнейшая оптимизация адаптационных процессов, лечение сопутствующих (как правило, инфекционно-воспалительных) заболеваний и начало собственно реабилитации, т. е. коррекции неврологических нарушений. Третий этап реабилитации — это специализированные стационары (отделение неврологии раннего возраста, центр реабилитации маловесных и недоношенных детей, центр коррекции), амбулаторные отделения реабилитации детских поликлиник (стационар-замещающие технологии). На всех этапах реабилитации перинатально пострадавших детей необходимо активное участие семьи больного ребенка; по показаниям, в конце первого — начале второго года жизни возможно привлечение специализированных детских дошкольных учреждений (группы коррекции в яслях и детских садах, центры коррекции). На втором и третьем этапах реабилитации используются практически одинаковые средства и методы, хотя выбор их зависит от индивидуального патокинеза болезни и эффективности коррекции на предыдущем этапе.
В практике большинства врачей фармакотерапия при перинатальных поражениях мозга занимает ведущее место, что далеко не всегда оправдано. В последнее десятилетие в условиях «фармацевтического бума» ежегодно появляются новые препараты, которые из области взрослой неврологии часто без достаточной проверки с позиций доказательной медицины попадают в арсенал средств, используемых неонатологом [5, 6, 7]. Назначая новорожденному лекарство, врач должен учитывать его возможные как ближайшие, так и отдаленные побочные эффекты (в том числе риск сенсибилизации), выбирать наименее травматичные пути введения лекарств: при необходимости проведения инъекций предусматривать обезболивание местными анестетиками типа пластыря ЕМLA или метаболитами [4, 6]. Во избежание ятрогений необходимо учитывать возможный синергизм или антагонизм фармакопрепаратов (не назначать более 3–4 лекарств одновременно), строго индивидуально выбирать дозировки (принцип минимизации, контроль индивидуальной фармакокинетики). Особая осторожность нужна при выборе алгоритма лечения глубоко недоношенных детей с экстремально низкой массой тела. Один из путей профилактики ятрогений в неонатологии — это использование гомеопатических препаратов [8], поскольку они содержат микродозы мягкодействующих растительных и минеральных веществ. Механизм действия этих препаратов не вполне ясен (возможны объяснения с позиций теории доминанты Ухтомского или теории биологического резонанса), тем не менее химическая эффективность некоторых из гомеопатических препаратов в неонатологии вполне доказана [4].
Фармакопрепараты, используемые в реабилитации как доношенных, так и недоношенных новорожденных, условно могут быть разделены на применяющиеся посиндромно (симптоматические) и средства преимущественно патогенетической коррекции, хотя некоторые препараты обладают и тем и другим воздействием. Рассмотрим их подробнее.
Медикаментозная реабилитация детей с перинатальными поражениями ЦНС — поздний неонатальный период, начало восстановительного периода
Преимущественно посиндромные (симптоматические) средства: противосудорожные: фенобарбитал, ГОМК, дроперидол, реланиум, вальпроаты — при некупируемых другими средствами судорогах и тщательном мониторинге функций печени и кроветворения; дегидратационные: диакарб (со 2–3-й недель жизни, у глубоконедоношенных — позднее), триампур, верошпирон, гомеопатические препараты (гелиборус, апис, магнезия фосфорика), сборы трав — отвары и настои; седативные (сульфат магния, сборы трав — отвары и настои, лечебные ванны, реланиум, радедорм, гомеопатические препараты — валерианахель, нервохель, вибуркол), эфирные масла, ароматерапия (анис, ромашка, лаванда); спазмолитики и прокинетики (при вегетативных нарушениях): но-шпа, церукал, риабал, мотилиум, гомеопатические препараты (нуксвомика, гомакорд, вибуркол, хапель).
Средства патогенетической направленности: нейропротекторы (ноотропы, ноотрофы, ингибиторы нейрального апоптоза) — пирацетам (ИСВ), кортексин, семакс, минисем, церебролизин, пантогам, глиатилин, глицин, аминокислотные композиты, стволовые клетки; вазоактивные препараты (нормализаторы общей и мозговой гемодинамики) назначаются при отсутствии угрозы кровотечений под контролем допплерографии: кавинтон, циннаризин, сермион, димефосфон, кверцетин, гомеопатические препараты (эскулюс композитум, траумель); модуляторы синаптической проводимости: мидокалм, дибазол; aнтиоксиданты и антигипоксанты: танакан, мексидол, токоферол, соевое масло, кудесан, димефосфон, биолан, актовегин; метаболиты и поливитаминные комплексы: глицин, биотредин, лимонтар, эссенциале, элькар, кудесан, корилип, кверцетин, бета-каротин, киндер биовиталь, поливит беби, церебрум композитум, мульти-табс, капли Береш Плюс.
Как следует из вышеизложенного, выбор препаратов ограничен и нужна поистине «снайперская» точность при их назначении, кроме того, необходим клинический и лабораторный неинвазивный контроль эффективности. Следует обратить внимание на возможность относительно нетравматичного введения препаратов — накожное (соевое масло), ингаляционные (эфирные масла при ароматерапии), ректальные суппозитории (многие гомеопатические средства). В неонатологии важно использование наиболее «чистых» препаратов, например целесообразен выбор из препаратов пирацетама лекарств, выпускаемых фирмой ИСВ (Бельгия, Швейцария). В перечне средств патогенетической направленности к ингибирующим нейральный апоптоз условно отнесены стволовые клетки (в строгом смысле это не фармакопрепарат), степень терапевтической эффективности которых еще нуждается в дальнейших исследованиях. В то же время от использования фетальных трансплантатов [3] следует решительно отказаться по соображениям общечеловеческой и медицинской этики.
Обеспечить минимизацию лекарственной терапии помогает раннее (начиная с первого этапа) включение в программу комплексной реабилитации немедикаментозных воздействий. На втором и третьем этапах реабилитации детей с перинатальной патологией эти методики должны быть признаны приоритетными [1]. Несомненно, в обеспечении успешной реабилитации важная роль принадлежит адекватному вскармливанию и оптимальной организации окружающей среды (лечебно-охранительный режим), но в настоящей статье эти вопросы не рассматриваются. Тем не менее некоторые аспекты организации выхаживания тяжелобольных детей (ограничение сенсорной нагрузки в остром периоде поражения мозга, температурный комфорт, ограничение электромагнитных воздействий, выхаживание на колышащихся матрасиках или на шерсти ягнят) могут быть отнесены к методам немедикаментозной реабилитации [1, 5, 6].
Перечислим средства немедикаментозного лечения и реабилитации, весьма условно разделив их на физические и психолого-педагогические, поскольку любое физическое воздействие на маленького ребенка предполагает обязательный психоэмоциональный контакт с ним.
Немедикаментозная реабилитация детей первого года жизни с перинатальными поражениями ЦНС
Физическая реабилитация: разнообразный лечебный массаж, лечебная гимнастика, лечение «положением» (укладки, туторы, «воротники» и т. д.), терапия по Войту; упражнения в воде и гидромассаж; сухая иммерсия (имитация невесомости); использование кроватки «Сатурн» (эффект невесомости + вибромассаж); физиотерапия (переменное магнитное поле, синусоидальные модулированные токи, электрофорез, парафинотерапия, лазеротерапия, свето- и цветотерапия).
Психолого-педагогическая коррекция и психоэстетотерапия: коррекционная (кондуктивная) педагогика; психотерапевтическая коррекция в диаде «мать–дитя» (контакт «кожа-к-коже», «кенгуру») и в целом в семье больного ребенка; музыкотерапия, эстетотерапия; тактильно-кинестетическая стимуляция.
Большинство из вышеперечисленных методик не являются новыми. В последние 3–5 лет к новым разработкам следует отнести методику мягкого вибромассажа в условиях невесомости (отечественная кроватка «Сатурн», ООО «Ритм», г. Екатеринбург), светотерапию и цветотерапию с помощью лампы линейного поляризованного видимого света «Биоптрон» («Цептер», Швейцария), тактильно-кинестетическую стимуляцию ладоней и пальцев, применяемую у детей с низкой и экстремально низкой массой тела [4]. В последние годы для недоношенных детей особенно рекомендуется сочетание двух-трех «мягких» методов физического воздействия с психоэмоциональной и психосенсорной коррекцией, что помогает моделировать эффект так называемых «сенсорных комнат», применяемых в реабилитации более старших пациентов [9].
Методика музыкотерапии для доношенных и недоношенных новорожденных детей, разработанная в клинике НЦЗД РАМН, включает как подбираемые индивидуально программы, записанные на магнитофон, так и пение кормящих матерей [4]. Матери обучаются комплексной мягкой психосенсорной стимуляции ребенка, напевают колыбельные и другие рекомендованные песни, учатся проведению мелоритмического воздействия (движение и тактильная стимуляция в сочетании с пением и чтением стихов) — элементам эвритмической терапии по Р. Штайнеру, который доказал благотворное влияние на организм ребенка ритмических движений под музыку [10].
В последние годы установлено, что начинать общение с ребенком необходимо еще в период внутриутробного онтогенеза; сегодня активно развивается перинатальная психология и перинатальная педагогика. Для детей с перинатальной патологией ЦНС раннее начало педагогической коррекции (элементы кондуктивной педагогики) является важнейшей составной частью реабилитации, поскольку мягкие сенсорные и эмоциональные воздействия — это немедикаментозные «ноотрофы» для развивающегося мозга [1, 4, 5, 6]. Ежедневное влияние родителей (прежде всего матери) направляется специалистом — психологом (педагогом), который формирует у родителей активную позицию по преодолению психоневрологических дефектов, обучает их разнообразным формам, приемам и средствам взаимодействия с ребенком и умению оценивать его реакции.
Целью ранней педагогической коррекционной работы является создание условий для поступательного психосоциального развития ребенка, для использования его индивидуального «потенциала компенсаций». На каждом возрастном этапе педагог решает определенные развивающие задачи: вначале это стимуляция интереса ребенка к окружающей среде, формирование исследовательского поведения, затем укрепление межанализаторных связей, расширение спектра сенсомоторных навыков и умений, повышение коммутативной активности, развитие и обогащение игровых и предметных действий, а также социальной активности ребенка [11].
В настоящей статье не затрагиваются некоторые специальные аспекты реабилитации (коррекция зрительных нарушений при ретинопатии недоношенных, нейросенсорной тугоухости, ортопедической патологии).
Использование широкого спектра немедикаментозных воздействий на втором и третьем этапах реабилитации больных детей позволяет (по данным клиники НЦЗД РАМН) уменьшить дозировки и длительность курсов фармакотерапии (по вазоактивным препаратам — на 15–20% и 3–3,5 дня; по мочегонным (диакарб) — на 20–30% и 2–3 дня; по седативным препаратам — на 30–40% и 4–5 дней). Эффективность комплексной реабилитации оценивалась в клинике по достижении детьми 1,5–2 лет. Функциональная компенсация неврологических и нейросенсорных нарушений имела место почти у всех детей со среднетяжелыми и легкими формами перинатальных поражений мозга и у 80% детей с тяжелыми (по оценке в периоде новорожденности) нарушениями. Кроме того, даже у детей, имевших в конце периода наблюдения инвалидность вследствие сенсорного или моторного дефекта, удавалось добиться некоторого смягчения моторных или сенсорных расстройств и соответственно несколько улучшить качество жизни.
Е. П. Бомбардирова, доктор медицинских наук, профессор
Г. В. Яцык, доктор медицинских наук, профессор
А. А. Степанов, кандидат медицинских наук
НЦЗД РАМН, Москва
Что такое родовая травма? Причины возникновения, диагностику и методы лечения разберем в статье доктора Курышова О.С., остеопата со стажем в 25 лет.
Над статьей доктора Курышова О.С. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Родовая травма — это повреждения тканей и органов ребёнка, вызванные механическими силами во время родов, и целостная реакция организма на эти повреждения, сопровождающаяся нарушением механизмов компенсации и приспособления [1] .
Во время родов маме и малышу приходится вместе преодолевать возникающие трудности. Мир, в котором рос, развивался и жил малыш внутриутробно, вдруг становится каким-то маленьким, тесным, сдавливающим, подталкивающим куда-то в страшную неизвестность. И двери в этот Новый мир не всегда открываются легко и непринуждённо. Поэтому в процессе родов может случится повреждение. Чаще всего его сразу замечают и принимают необходимые меры, а иногда возникает минимальная, скрытая травма, которая проявится только в дальнейшем.
Спрогнозировать течение родов и их последствия, к сожалению, очень трудно. Никто не застрахован от внезапных проблем и ошибок. Даже спокойные роды, прошедшие нормально и обошедшиеся без травм, оказывают влияние на организм новорождённого, так как тело ребёнка подвергается давлению, да и сам малыш проводит колоссальную работу, пробираясь на свет.
Причин травмирования младенца при рождении множество. К травмам может привести образ жизни мамы, неблагополучное течение беременности, инфекции, аномалии развития плода, несоответствие размера головки ребёнка и таза мамы, вмешательство врачей, введение роженице препаратов для ускорения родов или обезболивания, операция кесарева сечения и вмешательство природы, случая [12] .
По статистике, около 18 % малышей получают различные повреждения при рождении. Но статисты полагают, что показатель существенно занижен, поскольку диагностика родовых повреждений в роддомах России проводится очень редко. Зачастую педиатры и неонатологи списывают тревожные симптомы на врождённые патологии и неверный уход за младенцем.
Дело в том, что для диагностирования родовой травмы необходим комплекс обследований и анализов, которые назначаются чаще всего только при очевидных повреждениях. На деле же показатель травм различной степени очень высок: более 80 % новорождённых получают как микроповреждения, так и серьёзные травмы.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!Симптомы родовой травмы
Травмироваться во время родов могут как головка младенца, так и позвоночник, внутренние органы, мягкие ткани, кости и суставы.
Серьёзные травмы приводят к внешне заметным нарушениям, которые видны врачам и персоналу роддома сразу после рождения. Микротравмы и скрытые повреждения, не очевидные на первый взгляд, таят в себе ещё большую опасность, поскольку могут остаться незамеченными и стать незаподозренной первопричиной дальнейших проблем со здоровьем малыша.
Есть несколько групп признаков, которые указывают на наличие родовой травмы:
- Признаки травмирования мягких тканей: царапины, ссадины, синяки, опухлость, отсутствие пульсации и безболезненность родничка, желтуха и анемия.
- Признаки травмирования костной системы: отёк, припухлость, малоактивность повреждённой конечности, боль, беспокоящая ребёнка и выливающаяся в постоянный сильный плач.
- Признаки внутричерепной травмы: слабость, скачки температуры, удушье, спонтанное движение конечностей и глаз, судороги, выпячивание родничка, сонливость, тихий крик, деформации, укорочение рук и ног.
- Признаки травм внутренних органов: вздутие живота, слабость в мышцах, слабые рефлексы, частые срыгивания и рвота, низкое давление, артериальная гипотония.
- Признаки нарушений центральной нервной системы (ЦНС): вялость, слабость рефлексов и мышц, тихий крик, потливость, одышка, выгнутость груди, воспаление лёгких, искривление рта, затруднение сосания, смещение глазного яблока.
Если обнаруживаются несколько симптомов одной из этих групп, а хуже того — нескольких групп, то это повод заподозрить родовую травму и как можно скорее принять меры для её диагностирования и лечения. Их нельзя игнорировать, особенно когда состояние малыша не улучшается даже после вмешательств врачей. Ведь в таком случае устранять нужно не симптомы, а первопричину.
Чаще всего в процессе родов возникают повреждения головы младенца, приводящие к поражениям ЦНС: головного и спинного мозга, периферической нервной системы. При обнаружении подобных патологий у ребёнка требуется уточнить и доказать, что именно травма во время родов привела к появлению нарушений. Только при подтверждении данного факта можно выставлять диагноз "родовая травма" [2] .
Патогенез родовой травмы
По причине возникновения родовые травмы принято делить на неонатальные, спонтанные и акушерские.
Неонатальная родовая травма возникает из-за аномалий и патологий плода, которые можно диагностировать ещё на этапе беременности с помощью УЗИ, что позволяет предотвратить травму при появлении малыша на свет. Этот тип травмы также может появиться из-за проблем со здоровьем мамы во время вынашивания плода, быстрых или затяжных родов и т. д.
Спонтанная родовая травма наступает при обычных физиологических родах. Она связана со сбоями в родовом процессе или внешними факторами.

К травме зачастую приводит совокупность этих факторов, которые нарушают нормальное течение родов, и застраховаться от возможного сбоя биомеханики процесса рождения, к сожалению, невозможно.
Родовые травмы нередко возникают во время родов при тазовом предлежании плода, причём как у малыша (разрывы мозжечкового намёта, кровоизлияния, субдуральные гематомы, повреждение органов брюшной полости, спинного мозга и других), так и у матери (разрывы шейки матки, влагалища и промежности, повреждение костного таза) [3] [11] .
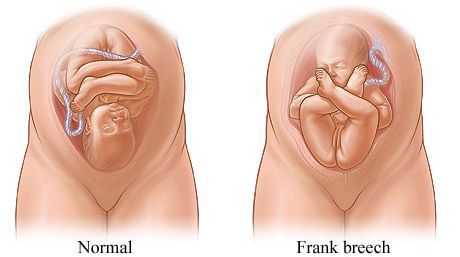
Отдельно стоит сказать о методах стимуляции родов и популярной в последнее время эпидуральной анестезии. Применение различных стимуляций не может не вносить коррективы в родовой процесс. Например, введение окситоцина делает схватки интенсивнее, что сказывается на младенце, который получает тройную нагрузку давления, проходя родовые пути. А эпидуральная анестезия ослабляет мышцы таза, уменьшая опору для головки малыша и заставляя его проделывать ещё более сложный путь к рождению.
Любое вмешательство, любая деталь имеет значение в процессе рождения и пройти незаметно, увы, не может. Тем более грубое или необоснованное вмешательство, например, такое, как кесарево сечение без серьёзных показаний.
Данная операция нарушает естественный, заложенный природой механизм появления ребёнка на свет. Младенец лишается возможности плавно войти в этот мир: его резко вырывают из привычной тёплой водной среды в непривычный воздушный мир, и это, безусловно, приводит к последствиям для дальнейшей жизни.
Классификация и стадии развития родовой травмы
Родовые травмы условно делят на два вида:
- механические — вызванные действиями акушера или внешними факторами;
- гипоксические — связаны с повреждением, вызвавшим гипоксию (кислородное голодание).
По месту локализации различают четыре вида родовых травм:
- Травмы нервной системы (центральной и периферической). К ним относят внутричерепные и спинальные кровоизлияния, причём последние возникают чаще [11] . К внутричерепным родовым травмам относят эпидуральные, субдуральные кровотечения и разрыв намёта мозжечка с кровоизлиянием в заднюю черепную ямку. При присоединении к таким нарушениям соматической и инфекционной патологии прогноз травмы ухудшается. К спинальной родовой травме относят кровоизлияния в спинной мозг и его оболочки, эпидуральную клетчатку при надрыве или повышенной проницаемости сосудов, частичный или полный разрыв спинного мозга.
- Травмы мягких тканей (родовая опухоль и кефалогематома). Родовая опухоль образуется из-за разницы между внутриматочным и атмосферным давлением, в связи с чем участок мягкой ткани отекает и возникают мелкие петехиальные кровоизлияния. Через 1-2 дня такая опухоль рассасывается. Кефалогематома возникает при кровоизлиянии под надкостницу черепа, она ограничена пределами одной кости. Рассасывается медленно. При проникновении инфекции и нагноении может развиться гнойный менингит.
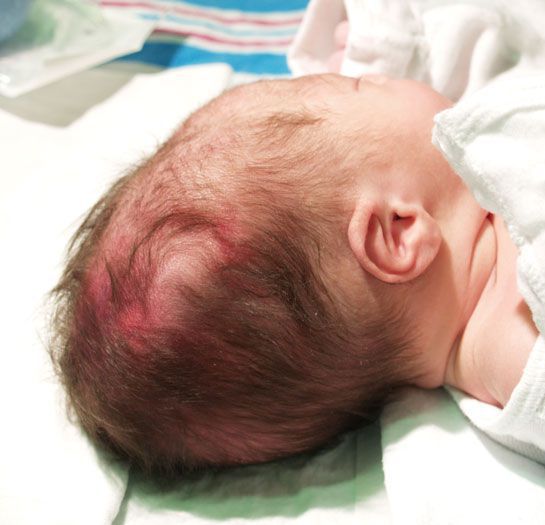
- Травма костной системы (переломы, вывихи). Кости черепа в основном повреждаются в области темени, где можно обнаружить впадины, трещины, и иногда переломы. Частой травмой костей скелета является перелом ключицы.
- Травма внутренних органов (сдавления, разрывы). Чаще всего травмируются печень, селезёнка и надпочечники [4] .
Осложнения родовой травмы
При неблагоприятном течении родов травма плода может привести к серьёзным поражениям головного и спинного мозга, костей и позвоночника. В результате этого возникают тяжёлые неврологические заболевания (ДЦП), отставание в умственном развитии, наступает инвалидность и даже смерть [6] .
В целом все болезни, возникающие в детстве, юности, зрелости и старости, не спонтанны. В 98 % случаев они являются закономерными этапами развития единого патологического процесса, начало которому положено ещё во младенчестве при появлении родовой травмы [5] .
Изначальные деформации укрепляются в организме, приводя к ещё большим проблемам, которые углубляются, усугубляются и со временем становятся необратимыми. Так, первичные нарушения зрения приводят к слепоте, а детское нарушения осанки — к вегетососудистой дистонии, сколиозу, проблемам со зрением и слухом, головным болям и хроническим заболеваниям.
Психологи и психоаналитики говорят также о психологических последствиях родовой травмы, которые сопровождают людей и во взрослой жизни. Отсюда — наши страхи, комплексы, депрессии, тревожность. Рождение само по себе является шоком, стрессом, болью для нового человека, из-за чего оно отпечатывается на подсознательном уровне, оказывая влияние на нашу жизнь, отношения с собой и окружающим миром, заставляя мозг как бы переживать эти ощущения снова и снова, пытаясь освободиться от замкнутого круга.
Поэтому стоит говорить о совокупности последствий, которые отпечатываются на самом глубинном уровне и неизбежно отражаются на физическом здоровье.
Только вовремя распознав и приняв необходимые меры, можно минимизировать или устранить последствия родовых травм, а в идеале — их предупредить. И чем раньше родители обнаружат симптомы родовой травмы и обратятся к специалистам для установления первопричины нарушений у малыша, тем легче будет преодолеть последствия болезни, обеспечить ребёнку, а значит и будущему взрослому, здоровую жизнь.
Диагностика родовой травмы
Для диагностики врач первым делом должен выяснить, поговорив с мамой и проверив лично, руками, не получил ли ребёнок родовой травмы, а если да, то где она локализована и насколько тяжела. При необходимости назначаются дополнительные обследования — УЗИ, ЭЭГ, рентгенографию, офтальмоскопию и другие. Однако они не всегда позволяют обнаружить повреждения. Например, небольшое смещение косточки невозможно увидеть и диагностировать, но эта вроде бы мелочь нарушает целостную работу организма, приносит ребёнку беспокойство и боли. Такие небольшие нарушения редко связывают с проблемами во время родов, а относят к другим факторам или к норме, не обращая должного внимания ("перерастёт"). В связи с этим большинство травм не фиксируется в карточке малыша.
Чаще всего специалисты диагностируют и лечат такие последствия родовой травмы, как кривошея, сколиоз, нарушения речи, сна, аппетита, чрезмерная возбудимость и т. д. Но не устранив истинную, изначальную причину этих симптомов, помочь организму трудно.
Диагностикой и лечением родовой травмы занимаются не только педиатры и неонатологи, но и остеопаты. Они могут обнаружить механические повреждения черепа и головного мозга, в том числе незначительное смещение костей черепа, которое осталось незамеченным при обследованиях, а также снять физические и психосоматические последствия травмы.
Лечение родовой травмы
Помимо хирургических и медикаментозных методов лечения, а также любви и заботы, огромную роль в устранении и минимизации последствий родовой травмы, особенно тяжёлой, играет физическое воздействие на тело — массаж, лечебная физкультура, мануальные техники, работа остеопата. Это процедуры укрепляют мышцы, налаживают обменные процессы и кровообращение, помогают восстановить скоординированность движений и подвижность конечностей, исправляют сколиоз, а также в целом укрепляют тело и организм.

Остеопатия рассматривает организм, как единое целое, систему, малейшее повреждение в которой нарушает работу всего организма, а родовые травмы — как первопричину большинства проблем с самочувствием и развитием детей.
Чем раньше малыш окажется в руках остеопата, тем больше вероятность того, что травма ещё не оказала необратимое влияние на организм и развитие ЦНС и можно устранить или как минимум сгладить её последствия.
С помощью профессиональных манипуляций врач выявляет место смещения косточки, помогает восстановить её положение в черепе и кровообращение мозга. Методы воздействия — немедикаментозные, щадящие, бережные, а действия врача не приносят ребёнку стресса и боли, что также оказывает положительное влияние на процесс восстановления [7] .
Если случай нетяжёлый, то после курса лечения поставленный диагноз снимается, но прежде это нужно подтвердить при помощи инструментального исследования (например, МРТ). При тяжёлой травме или несвоевременном обращении за помощью сеансы помогут значительно улучшить состояние маленького пациента.
Травмы при родах часто получают и роженицы, поэтому им также необходима помощь в устранении последствий.
Прогноз. Профилактика
Прогноз выздоровления после родовой травмы зависит от тяжести повреждений, а также от своевременно оказанной помощи, грамотной диагностики и терапии. Полностью избежать последствий при правильном лечении удаётся у 70-80 % детей. Могут оставаться небольшие проявления — отголоски травмы, отдельно поддающиеся лечению: беспокойство, энурез, головные боли, проблемы с аппетитом и т. п.
Если травмы не поддаются лечению или помощь была оказана поздно или неквалифицированно, то возможны и более страшные последствия: ДЦП, эпилепсия, задержки развития, умственная отсталость и летальный исход.
К мерам профилактики родовых травм можно отнести:
- грамотное ведение беременности;
- оценка и предотвращение возможных проблем, связанных с внутриутробными патологиями плода, анамнезом матери и возможными рисками;
- серьёзное и внимательное отношение будущей матери к беременности, отказ от вредных привычек;
- комфортное ведение родов, заботливое и аккуратное отношение к матери и ребёнку в процессе родоразрешения, недопущение необоснованного акушерского вмешательства и отказ от операций кесарева сечения без веских показаний [12] ;
- внимательность педиатра к симптомам и жалобам в первые дни после родов и его подготовленность в данном вопросе [9] .
Кефалогематома – родовая травма, которая характеризуется скоплением крови между костью черепа и отслоенной от нее надкостницей. Клинически проявляется наличием безболезненного флюктуирующего опухолевидного образования упругой или мягкой консистенции. Типичная локализация – область теменной кости. Диагностика включает объективное обследование ребенка, проведение нейросонографии и рентгенографии. Тактика лечения зависит от степени выраженности субпериостального кровоизлияния. При кефалогематомах I-II степени специфическое лечение обычно не требуется, при кефалогематоме III степени показана пункционная аспирация.
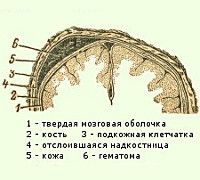
Общие сведения
Кефалогематома, или субпериостальное кровоизлияние – патология, при которой наблюдается отслоение периоста от кости черепа с кровоизлиянием в образовавшееся пространство. Является наиболее частой родовой травмой новорожденных в педиатрии и неонатологии. Распространенность составляет порядка 0,2-2,5% от всех новорожденных. Осложнения характерны только при больших объемах кровоизлияний. Наиболее частными осложнениями являются анемия, обызвествление, желтуха и присоединение гноеродной микрофлоры. Крайне редко развиваются ДЦП, неврологические нарушения и отставание в психофизическом развитии. Гендерной склонности к заболеванию не обнаружено. В некоторых случаях кефалогематома является признаком врожденных коагулопатий или генерализованного микоплазмоза. Важную роль играет дифференциальная диагностика с другими родовыми травмами.

Причины и классификация кефалогематомы
Непосредственная причина развития кефалогематомы – повреждение субпериостальных (реже – внутрикостных) сосудов. Механизм развития заключается в смещении кожных покровов головы и надкостницы по отношению к кости во время родовой деятельности. При этом возникает местное кровотечение, в сформированной полости образуется гематома. Объем кровоизлияния колеблется от 5 до 150 мл. Несколько реже кефалогематома образуется в месте трещин костей черепа (как правило – II и III степень). Причинами развития заболевания со стороны плода являются большая масса тела (свыше 4000 г), патологическое предлежание (тазовое, лицевое, поперечное), внутриутробные аномалии развития (гидроцефалия) и вынашивание более 40 недель (чрезмерное уплотнение костей, препятствующее изменению конфигурации черепа во время родов). Список причин со стороны матери включает использование акушерских пособий (щипцов или вакуум-экстракторов), клинически или анатомически узкий таз, стремительные или затяжные роды, нерегулярную и асинхронную сократительную деятельность матки, переломы таза в анамнезе, костные экзостозы, возраст от 35 лет и старше.
В некоторых случаях кефалогематома становится следствием асфиксии, вызванной обвитием или сдавливанием пуповины, западением языка и аспирацией околоплодных вод. Кроме того, кровоизлияние в периост костей черепа может являться первым признаком коагулопатий (гемофилии, болезни Виллебранда). У детей со сроком гестации до 37 недель данная патология может быть проявлением генерализованного внутриутробного микоплазмоза.
В зависимости от диаметра кефалогематомы выделяют 3 степени заболевания: I степень – не более 4 см, II степень – от 4 до 8 см, III степень – 8 и более см. При наличии нескольких очагов их диаметр суммируется и оценивается как одно кровоизлияние. С учетом места возникновения различают теменную (наиболее характерная), лобную, затылочную (менее распространенные) и височную (крайне редкая) кефалогематомы. Существуют изолированные и сочетанные формы заболевания. Изолированная кефалогематома не сопровождается другими патологиями. О сочетанной кефалогематоме говорят при одновременном наличии поверхностного кровоизлияния, переломов костей черепа и повреждения тканей головного мозга (отека, кровоизлияний в мозговую ткань, неврологических расстройств).
Симптомы кефалогематомы
Кефалогематома может проявляться как в первые 2-3 часа, так и на 2-3 сутки после родов. Общее состояние ребенка зависит от наличия других патологий, изолированные гематомы на состояние пациента не влияют. Нередко кровоизлияние увеличивается в первые несколько дней после возникновения, что обусловлено дефицитом факторов свертывания крови у новорожденных. Внешне субпериостальное кровоизлияние имеет вид локальной опухоли с четкими краями, не выходящими за границы пораженной кости. Средний размер гематомы составляет 3-7 см. Крайне редко наблюдаются множественные кефалогематомы, поражающие несколько участков головы.
При осмотре неонатолог или педиатр определяют безболезненное образование упругой мягкой консистенции с валикообразным уплотнением по периферии, позитивный симптом флюктуации и отсутствие местной пульсации. При небольшом диаметре (до 3 см) кровоизлияние обычно самостоятельно уменьшается на 7-9 сутки и полностью исчезает спустя 5-8 недель. Большие кефалогематомы (свыше 8 см), необходимо пунктировать для аспирации содержимого – самостоятельно они не рассасываются.
Наиболее распространенными осложнениями кефалогематомы являются анемия, нагноение, обызвествление и желтуха. Анемия, как правило, обусловлена большой кровопотерей, носит характер гемолитической или постгеморрагической и проявляется характерной клинической картиной, включающей бледность кожных покровов, повышение ЧСС и ЧД и другие симптомы. Присоединение гноеродной микрофлоры (β-гемолитического или других стрептококков группы А) сопровождается классическими признаками воспалительного процесса. Отмечается общее и местное повышение температуры тела, резкое ухудшение состояния ребенка и локальное покраснение в области гематомы. Обызвествление кефалогематомы обусловлено отложением солей кальция в образовавшейся полости. Проявляется деформацией пораженной кости и общей асимметрией черепа. Желтуха возникает на фоне внесосудистого гемолиза эритроцитов внутри гематомы.
Диагностика кефалогематомы
Диагностика кефалогематомы базируется на анамнестических и физикальных данных, результатах лабораторных и инструментальных методов исследования. Важную роль играет дифференциальная диагностика. Из анамнеза удается установить наличие провоцирующих факторов со стороны матери и/или ребенка. Физикальное обследование позволяет выявить опухолевидное образование над одной из костей черепа новорожденного (чаще всего над теменной). При детальном обследовании оцениваются консистенция и четкость краев образования, наличие пульсации и флюктуации.
Лабораторные тесты при кефалогематоме малоинформативны и обычно используются для исключения других заболеваний. Иногда в общем анализе крови определяется снижение количества эритроцитов и гемоглобина, в биохимическом – повышение общего билирубина за счет непрямой фракции. Обязательным методом диагностики кефалогематомы является нейросонография, позволяющая обнаружить эхонегативную зону между периостом и костью, а также подтвердить отсутствие поражений тканей головного мозга. Рентгенологическое исследование дает возможность исключить или подтвердить переломы костей черепа и выявить отслоение надкостницы с четкой границей в пределах одной кости. При неоднозначности полученных результатов и подозрении на повреждение тканей ЦНС используют КТ. Дифференциальную диагностику кефалогематомы проводят с подапоневротическим кровоизлиянием, родовой опухолью, грыжей головного мозга, редко – врожденным микоплазмозом и коагулопатиями.
Лечение кефалогематомы
Тактика лечения зависит от степени выраженности кефалогематомы, наличия сопутствующих патологий и тенденции к рассасыванию или прогрессированию. При крупных кровоизлияниях и тяжелом общем состоянии лечение проводится в условиях отделения патологии новорожденных или нейрохирургического отделения. При удовлетворительном общем состоянии и отсутствии других заболеваний ребенок выписывается домой под наблюдение педиатра или семейного врача. Режим постельный. Первые 3-4 дня кормление проводится сцеженным материнским молоком, после чего пациента переводят на вскармливание грудью. Для предотвращения дальнейших кровотечений и профилактики геморрагической болезни новорожденных осуществляют однократное введение витамина К.
Кефалогематома III степени при отсутствии положительной динамики является показанием к аспирационной пункции. Процедуру проводят не ранее 10 дня жизни ребенка, поскольку удаление крови на ранних сроках почти всегда влечет за собой рецидив кефалогематомы. Ориентировочная продолжительность лечения в условиях нейрохирургического стационара составляет от 2 до 7 суток. При нарушении целостности кожных покровов в зоне кровоизлияния аспирацию проводят в первые двое суток в связи с высоким риском инфицирования. При получении гнойного содержимого во время пункции показано вскрытие и дренирование полости на фоне антибактериальной терапии. Линейные трещины костей черепа специфического лечения не требуют.
Прогноз и профилактика кефалогематомы
Прогноз для детей с кефалогематомой, как правило, благоприятный. Заболевание редко влияет на общее состояние, дальнейшую жизнь и здоровье ребенка. Диспансерное наблюдение не требуется. Серьезные осложнения наблюдаются чрезвычайно редко.
Профилактика заключается в адекватном питании и образе жизни матери во время вынашивания ребенка, полноценном обследовании в период беременности, регулярном посещении женской консультации, своевременном выявлении факторов риска и правильном ведении родовой деятельности. При наличии показаний показано родоразрешение путем кесарева сечения.
По данным мировой литературы частота регистрации кефалогематом у новорожденных детей составляет 0,2–4,0%. Кефалогематомы наиболее часто развиваются после применения вакуум-экстракции. Большинство поднадкостничных кровоизлияний у детей разрешается самостоя
According to world literature, the frequency of registration of cephalogemate in newborns is 0,2–4,0%. Cephalohematomas most often develop after applying vacuum extraction. Most subperiosteal hemorrhages in children are resolved on their own. In 2–5% of cases, resorption of cephalohematomas does not occur and complications may occur in the form of suppuration and calcination. Routine puncture and aspiration with cephalogemate in children should not be carried out.
Кефалогематома, или кефалгематома, — это кровоизлияние под надкостницу плоских костей свода черепа [1–5]. В Международной статистической классификации болезней и проблем, связанных со здоровьем, 10-го пересмотра применяется формулировка «P12.0. Кефалгематома при родовой травме» [5–8]. По данным мировой литературы частота регистрации кефалогематом у детей составляет от 0,2% до 4,0% и не имеет существенной тенденции к снижению [9–15]. Изучение факторов риска, механизмов формирования, клинических особенностей и лечения кефалогематом у детей является актуальным вопросом в неонатологии и педиатрии [1, 2, 9, 10, 16, 17].
Целью настоящей работы было провести обзор публикаций по вопросам этиологии, механизмам формирования, клиническим особенностям и лечению кефалогематом у детей. Обзор проведен в онлайновых базах данных, включая Medline, Web of Science, PubMed, Scopus и Кокрейновском центральном регистре контролируемых испытаний за последние 7 лет (с 2012 по 2019 гг.).
Факторы риска
По данным обзора факторы риска формирования кефалогематом можно разделить на три основные группы: материнские, родовые и плодовые [18, 19]. Многие из них совпадают с причинами развития других натальных травм у детей [1, 2, 15, 19]. К материнским факторам относят возраст женщины (до 16 лет и старше 35 лет), аномалии таза, хронические заболевания матери [1, 2, 4, 19–21]. Чаще кефалогематомы регистрируются при родах у первобеременных и первородящих женщин, а также у женщин с инфантилизмом [18–21]. Сердечно-сосудистые, эндокринные и другие хронические заболевания у матери вызывают снижение адаптационных возможностей плода [19–21]. Плохо контролируемый сахарный диабет у женщины является одной из основных причин макросомии плода и, как следствие, развития кефалогематом [19, 21]. Рутинное назначение антикоагулянтов и антиагрегантов беременным женщинам влияет на механизм свертывания крови у плода и может тем самым способствовать формированию кефалогематом [15, 19, 21]. К родовым факторам риска относятся состояние родовых путей матери, метод родоразрешения, затяжные и быстрые роды, маловодие, применение акушерских пособий и инструментальных методик [1, 2, 5, 13–15, 18, 19, 22]. Кефалогематомы чаще регистрируются у детей, рожденных через естественные родовые пути [15, 18, 22]. Частота развития кефалогематом связана с квалификацией и навыками медицинского персонала, оказывающего пособие в родах [2, 5, 13, 14, 18, 20]. Использование вакуумной экстракции и акушерских шипцов приводит к увеличению риска развития кефалогематом в 3–4 раза [11, 18, 20, 23]. К плодовым факторам риска относят недоношенность, переношенность, тазовое или ягодичное предлежание, аномалии развития, большой размер головки и макросомию [1, 2, 5, 13, 14, 18, 20]. Кефалогематомы чаще регистрируются у мальчиков по сравнению с девочками [5, 19, 21]. Вес ребенка 4,0–4,5 кг при рождении связан с двукратным увеличением риска родовой травмы. Этот риск увеличивается в 3 раза, если вес при рождении составляет от 4,5–5,0 кг, и более чем в 4,5 раза, если новорожденный весит более 5 кг [18, 20]. Многие авторы отмечают, что кефалогематома может сформироваться и вне прямой связи с предрасполагающими факторами и доля таких случаев составляет 30–32% [5, 7, 13, 14, 21].
Механизм формирования кефалогематом
При сильном сдавлении костей черепа во время прохождения головки по родовому каналу происходит сдвигание надкостницы и ее отслойка. Это приводит к повреждению и разрыву кровеносных сосудов, вследствие чего кровь собирается в поднадкостничном пространстве [1, 2, 4, 8, 11]. Отслойка надкостницы происходит при выраженной конфигурации головки, а также при использовании акушерских щипцов и вакуум-экстракции [2, 18, 21, 22]. В 5–25% случаев кефалогематома может формироваться при трещинах и переломах костей черепа [17, 20]. Так как при кефалогематоме кровотечение возникает в ограниченном поднадкостничном пространстве, и при увеличении объема кефалогематомы кровеносные сосуды пережимаются и сдавливаются, что способствует самостоятельной остановке кровотечения [1, 2, 4].
Клинические особенности
Формирование кефалогематомы обычно происходит в течение первых 24–72 часов жизни новорожденного ребенка. Сразу после рождения ребенка диагностировать поднадкостничное кровоизлияние достаточно сложно из-за наличия родовой опухоли [1–5, 11]. Кефалогематома может располагаться на любой кости свода черепа: теменной, затылочной, височной, лобной [1–5]. Наиболее часто кефалогематома формируется в области теменных костей из-за того, что на них оказывается наиболее сильное воздействие во время родов [4, 9]. На втором месте по частоте встречаемости находится затылочная кость, на третьем месте — височная кость [5, 14]. В области теменных костей встречается 83–88% кефалогематом, а в области затылочной кости регистрируется только 6–12% [8, 19, 21]. По данным С. В. Баринова частота встречаемости односторонних кефалогематом составляет 89%, двусторонних — 11,0% [21]. Формирование нескольких кефалогематом у одного ребенка происходит наиболее часто в области правой и левой теменной кости [5, 8, 18, 23]. Поднадкостничное кровоизлияние, как правило, округлой или овальной формы, с четко определяемыми границами, плотной, упругой, напряженной консистенции [5, 18, 20]. Кефалогематома никогда не переходит на соседнюю кость [1, 2, 4, 11, 14]. Поднадкостничное кровоизлияние не пульсирует, безболезненно. Поверхность кожных покровов над кефалогематомой, как правило, не изменена, но иногда могут быть мелкие кровоизлияния, петехии [1, 2, 4, 11, 14]. Увеличение размеров кровоизлияния может происходить в течение первых 3 суток жизни [1–3, 5, 11, 18, 20]. По размеру кефалогематомы разделяют на малые или 1-й степени (размер до 4 см), средние или 2-й степени (от 4,1 до 8 см) и большие или 3-й степени (размер более 8,1 см). При оценке размеров учитывается максимальный диаметр кровоизлияния. Чаще у детей встречаются кефалогематомы 2-й степени (до 65%), реже регистрируются кефалогематомы 1-й степени (до 25%) и 3-й степени (до 10%) [1, 2, 9, 21, 24]. При больших кровоизлияниях из-за секвестрации крови может возникать гипотония, анемия, желтуха [1, 2, 4]. По данным В. А. Прилуцкой гипербилирубинемия регистрируется в 11% случаев [24]. У детей необходимо контролировать уровень гематокрита, гемоглобина, гемодинамические показатели, коагулограмму, общебиохимические показатели, в том числе уровень билирубина [1, 2, 4]. Кефалогематома может быть одним из клинических проявлений геморрагической болезни новорожденных детей, тромбопатии, гемофилий А, В и С, гипофибриогенемии, афибриногениемии и дисфибриногенемий, а также других наследственных коагулопатий [1–4, 19, 21, 24]. Резорбция кефалогематомы начинается к 10–14 суткам жизни. С началом резорбции центр ее становится несколько утопленным, а по краям кровоизлияния начинает образовываться плотный валик [1–3, 5, 9, 11, 18, 20]. Полная резорбция большинства поднадкостничных кровоизлияний наступает к 6–8 неделе жизни ребенка. В 2–5% случаев резорбция кефалогематомы не происходит и могут возникать осложнения в виде нагноения и кальцинации [1, 2, 9, 11].
Кальцинация кефалогематомы
Длительно сохраняющаяся кефалогематома может кальцинироваться. В литературе это осложнение часто называется оссификацией или окостенением кефалогематомы [5, 8, 14]. Частота развития кальцинации кефалогематом составляет 2–5% [8, 11, 14, 24]. Кальцинированные кефалогематомы изменяют контур свода черепа, что приводит к стойкой деформации и асимметрии головы у ребенка [1, 5, 8, 9, 11, 22]. Кальцинированные кефалогематомы предложено делить на два типа [5, 8]. Кефалогематомы с кальцинацией по 1-му типу характеризуются тем, что внутренняя пластинка имеет нормальный контур и не вдавлена в сторону полости черепа. При кальцинации по 2-му типу происходит вдавление внутренней пластинки в полость черепа [5, 8, 11]. 1-й тип кальцинированных кефалогематом возникает при небольших размерах кровоизлияния. 2-й тип регистрируется при больших размерах поднадкостничного кровоизлияния [8]. Деление кальцинированных кефалогематом на варианты важно для определения хирургической тактики ведения таких детей [5, 11]. При 1-м типе кальцинированной кефалогематомы проводится поднадкостничное удаление оссифицированной гематомы. При 2-м типе может потребоваться проведение краниопластики для восстановления свода черепа [8, 11].
Нагноение кефалогематомы
Развитие нагноения кефалогематомы является редким, но очень опасным осложнением [16, 25]. В зарубежной литературе это осложнение часто называется инфицированием кефалогематомы [16, 18, 25, 26]. К факторам риска развития нагноения относят длительный безводный период, инструментальные пособия в родах, ссадины и повреждения кожных покровов на голове, бактериемию, применение электродов при внутриутробном мониторинге [16, 25]. Первичная инфекция возникает в результате повреждения кожных покровов в области головы. Вторичная инфекция появляется в результате бактериемии, а также при сепсисе или менингите [16]. При микробиологическом исследовании нагноившихся кефалогематом наиболее часто выделяется кишечная палочка [16, 18, 25, 26]. На втором месте находится золотистый стафилококк, на третьем месте — протей [16, 18, 25, 26]. При нагноении кефалогематомы появляются локальные и системные признаки инфекции [16]. К локальным признакам относят эритему, флюктуацию, болезненность, изменения кожных покровов, гнойное отделяемое [1, 2, 16, 25, 26]. Системными признаками являются нарушения терморегуляции, беспокойство, раздражительность, а также возможны вялость, отказ от еды, плохое сосание, нарастание желтухи и бледности [16, 25]. Может быть лейкоцитоз и повышение уровня С-реактивного белка [25]. Инфицирование кефалогематомы часто приводит к развитию сепсиса, менингита, остеомиелита и смерти [16, 18, 25, 26]. При нагноении кефалогематомы менингит развивается у 26% детей, сепсис у 42% [16]. Показатели смертности при развитии сепсиса составляют 35,7% [26]. Основным методом лечения нагноившегося поднадкостничного кровоизлияния является аспирация и дренирование, а также назначение антибактериальной терапии с учетом чувствительности возбудителя [16, 25, 26].
Наблюдение и лечение
Дети с поднадкостничными кровоизлияниями обычно не нуждаются в какой-либо медикаментозной терапии. Для большинства кефалогематом характерна самостоятельная резорбция и полное разрешение в течение нескольких недель или месяцев. [1–4]. У пациентов предлагается проводить только динамическое клиническое наблюдение [5, 14]. При наличии болевого синдрома необходимо проведение немедикаментозного и медикаментозного обезболивания [1]. В настоящее время большинство авторов считает, что проведение пункции и аспирации кефалогематом не показано. При пункции кефалогематомы имеется высокий риск возникновения тяжелых инфекционных осложнений [1–3, 5, 9]. Аспирация гематом может способствовать возникновению повторных кровотечений [1–3, 5, 9]. Большой интерес вызывают клинические алгоритмы по ведению детей с кефалогематомами, которые используются в других странах. В Республике Казахстан в 2017 г. утвержден клинический протокол диагностики и лечения кефалогематом у новорожденных. Согласно протоколу, ребенок с кефалогематомой 1-й степени (размер до 4 см) не нуждается в госпитализации в стационар. Госпитализация в стационар показана только детям с большими кефалогематомами, с длительно сохраняющимися кефалогематомами (больше 10 дней), а также при развитии анемии, гипербилирубинемии и появлении признаков инфицирования кефалогематомы. Хирургическое вмешательство проводится только при нагноении кефалогематомы [9].
Литература
А. Ф. Киосов, кандидат медицинских наук
ГБУЗ ОКБ № 2, Челябинск
Кефалогематомы у детей/ А. Ф. Киосов
Для цитирования: Лечащий врач № 10/2019; Номера страниц в выпуске: 52-55
Теги: акушерские щипцы, вакуум-экстракция, родовая травма, осложнения.
Читайте также:

