Shaken baby syndrome что это
Обновлено: 05.07.2024
Педиатры и детские неврологи снова говорят о синдроме встряхнутого ребенка "Shaken baby syndrome" или по-русски, синдроме детского сотрясения.
В эпоху осознанного родительства мы расширяем информативные границы мам и пап, поэтому о данном синдроме должен знать любой, особенно потенциальный родитель.
Потому что даже секундная вспышка гнева может привести к плачевным последствиям, которые придется лечить всю жизнь.
В первые месяцы жизни ребенка в подавляющем большинстве русских семей мама испытывает колоссальные перегрузки, которые естественно влияют на психику женщины. Это в американских семьях принято делить радости и беды родительства между двумя родителями. Будущие американские мама и папа составляют графики "дежурства", в том числе и ночные, чтобы распределить недосыпание и обязанности по уходу за ребенком. Возможно, это происходит потому, что американская мама не имеет такой роскоши, как русская - 3 декретных года - и выходит на работу спустя пару месяцев, а то и раньше.
И вот когда малыш долго не может успокоиться, а уставшая мама перепробовала все способы успокоения, возникает острое желание потрясти его в ярости. И очень часто такое желание реализовывается. Еще и потому, что наши мамы и бабушки учат нас, что успокоить ребенка проще всего ритмичной тряской.
Что происходит в этом случае? Если совсем упростить схему, то получится примерно так: мышцы шеи младенца слабы, он еще даже не научился держать головку, поэтому при тряске голова ребенка будет достаточно свободно болтаться, а ее содержимое - головной мозг - будет достаточно легко травмироваться о кости черепа. Возникает триада патологических проявлений: субдуральное кровоизлияние, кровоизлияние в сетчатку и аксональное повреждение. Причем такая динамичная тряска ребенка будет иметь более серьезные последствия даже чем падение с небольшой высоты.
Симптомы синдрома детского сотрясения:
- чрезвычайная суетливость или раздражительность;
- вялость, сонливость;
- проблемы с дыханием;
- плохой аппетит;
- рвота;
- бледная или голубоватая кожа;
- судороги;
- параличи;
- потеря сознания.
Очень важно помнить и понимать: даже кратковременное встряхивание младенца может привести к необратимому повреждению мозга!
Осложнения
Почти у половины больных с мультисистемным воспалительным синдромом развивается дыхательная недостаточность, в т.ч. респираторный дистресс-синдром, требующие кислородной поддержки. Тревожным признаком служит нарастание цианоза, одышки, втяжение межреберных промежутков. Кардиоваскулярные осложнения включают коронарит, перикардит, миокардит, вальвулит. В отдельных случаях МВС сопровождается аритмией, СН, острым коронарным синдромом. Опасным отдаленным осложнением служат аневризмы коронарных артерий.
Синдром кошачьего крика
Синдром «кошачьего крика» – хромосомное нарушение, обусловленное делецией (отсутствием) фрагмента короткого плеча 5-ой хромосомы. Плач новорожденных с синдромом «кошачьего крика» по звуку напоминает кошачье мяуканье, что и послужило названию патологии. Кроме этого, у детей имеет место микроцефалия, лунообразное лицо, косоглазие, аномалии прикуса, различные врожденные пороки, грубое интеллектуальное недоразвитие и т. д. Синдром «кошачьего крика» диагностируется на основании совокупности характерных признаков и цитогенетического исследования. Специфического лечения синдрома «кошачьего крика» не существует; дети могут нуждаться в хирургической коррекции тяжелых врожденных аномалий.

Диагностика
Диагностика ДМВС складывается из клинических критериев, дополненных данными лабораторных и инструментальных методов. Обследование проводится стационарно с привлечением детских неврологов, кардиологов, пульмонологов, реаниматологов. На наличие мультисистемного воспалительного синдрома указывает:
- положительный эпиданамнез (COVID-19, подтвержденный с помощью ПЦР или ИФА, либо контакт с больным);
- лихорадка >38°С длительностью более суток;
- симптомы поражения 2-х и более систем (гастроинтестинальные, неврологические, кардиоваскулярные, респираторные, дерматологические, почечные).
Для дальнейшей оценки функции органов проводятся:
- Лабораторные исследования. Для ОАК типична высокая СОЭ, нейтрофилез, лимфопения, тромбоцитопения. Изменения биохимического состава крови при ДМВС представлены повышением трансаминаз, триглицеридов, гипоальбуминемией. Маркерами острого воспаления служит нарастание уровней СРБ, прокальцитонина, ферритина, ИЛ-6; острого коронарного повреждения – повышение тропонина и NT-proBNP; коагулопатий – увеличение фибриногена, D-димера.
- Кардиодиагностика. По электрокардиографическим данным могут регистрироваться нарушения ритма, блокады сердца, подъем ST-сегмента. На ЭхоКС определяется снижение фракции выброса, гипокинезия ЛЖ, перикардиальный выпот, дилатация или аневризмы венечных артерий.
- Диагностика респираторных нарушений.Рентген грудной клетки помогает обнаружить выпот в полости плевры. С помощью КТ легких обнаруживается симптом «матового стекла», являющийся типичным признаком ковидной пневмонии. Альтернативным методом может служить УЗИ легких и плевральных полостей. Пульсоксиметрия выполняется для оценки степени гипоксемии.
- Визуализация ОБП. При проведении УЗИ брюшной полости может быть выявлена гепатоспленомегалия, брыжеечная лимфаденопатия, асцит. Иногда прибегают к проведению колоноскопии (определяется терминальный илеит, колит), диагностической лапароскопии.
Дифференциальная диагностика
Детский МВС по своим клиническим проявлениям сходен с другими воспалительными и инфекционными процессами. В рамках лабораторно-инструментального обследования дифдиагностика проводится со следующими состояниями:
- бактериальный сепсис (подтверждается по данным посева крови);
- синдром Кавасаки (менее выражены гастроинтестинальные и кардиологические симптомы, воспалительные маркеры);
- аппендицит (исключается с помощью сонографии, КТ);
- гемофагоцитарный лимфогистиоцитоз (требуется проведение иммунологического тестирования);
- системная красная волчанка (МВС развивается у ранее здоровых детей без предшествующего анамнеза СКВ);
- васкулиты (для дифдиагностики требуется биопсия);
- прочие вирусные инфекции: энтеровирусная, аденовирусная, цитомегаловирусная, ВЭБ-инфекция (выявляются методами ПЦР, серологии).
Причины
Этиологически заболевание связано с перенесенной инфекцией COVID-19. Предполагается, что мультисистемный воспалительный синдром является постинфекционным осложнением, а не проявлением острой коронавирусной болезни. Как правило, ДМВС развивается через 1-6 недель после острой фазы. К этому времени у 2/3 детей ПЦР-тесты на SARS-CoV-2 становятся отрицательными, но при этом обнаруживаются антитела к коронавирусу.
Факторы риска
Условия, на фоне которых детский мультисистемный синдром воспаления развивается чаще, включают:
- расовую принадлежность (чаще – у темнокожих, латиноамериканцев; реже – у европейцев, азиатов);
- мужской пол (60% составляют мальчики и юноши);
- сопутствующие заболевания (бронхиальная астма, ожирение).
Прогноз и профилактика синдрома «кошачьего крика»
На продолжительность и качество жизни больных влияет тяжесть самого синдрома и сопутствующих врожденных пороков, уровень оказания медицинской и психолого-педагогической помощи. В целом долговременный прогноз неблагоприятный. При специальном обучении дети имеют словарный запас, достаточный для бытового общения, однако по уровню психомоторного развития обычно не поднимаются выше дошкольников.
Профилактика синдрома «кошачьего крика» заключается в тщательной подготовке к беременности и исключении возможных неблагоприятных воздействий на организм родителей еще задолго до зачатия. При рождении в семье ребенка с синдромом «кошачьего крика», родители в обязательном порядке должны пройти цитогенетическое обследование для исключения носительства реципрокной сбалансированной транслокации.
Общие сведения
Синдром «кошачьего крика» (синдром Лежена) – частичная моносомия, связанная с нарушением структуры короткого плеча 5-ой хромосомы (потерей от 1/3 до 1/2 его длины, реже - полной утратой короткого плеча). Синдром «кошачьего крика» относится к числу редких хромосомных заболеваний с популяционной частотой 1:45-50 тыс. Среди новорожденных с синдромом «кошачьего крика» отмечается преобладание девочек над мальчиками в соотношении 4:3. Заболевание было описано в 1963 г. французским генетиком и педиатром Ж. Леженом и по автору получило название «синдром Лежена». Однако в литературе за данной патологией закрепилось образное название, связанное со специфическим признаком – плачем новорожденных, напоминающим кошачий крик.

МКБ-10
Мультисистемный воспалительный синдром у детей
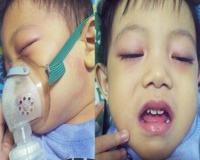
Мультисистемный воспалительный синдром у детей – это ассоциированный с COVID-19 симптомокомплекс, встречающийся у детей и подростков, включающий признаки болезни Кавасаки и токсического шока. Клиническая картина представлена лихорадкой, нарушениями функции ЖКТ, менингеальными симптомами, кожной сыпью, конъюнктивитом, гипотонией, миокардитом. Лабораторная диагностика требует подтверждения инфицирования SARS-CoV-2, оценки маркеров воспаления, системы гемостаза; инструментальная – проведения ЭхоКС, КТ грудной клетки, УЗИ. В лечении используются оксигенотерапия, ГКС, антикоагулянты, иммуноглобулины, антибиотики.
Симптомы синдрома «кошачьего крика»
Новорожденные с синдромом «кошачьего крика», как правило, рождаются доношенными, но с небольшой пренатальной гипотрофией (средняя масса при рождении около 2500 г). Беременность у матери может протекать абсолютно нормально или сопровождаться угрозой самопроизвольного прерывания не чаще, чем в популяции. Наиболее патогномоничным ранним признаком синдрома является плач ребенка, который напоминает мяуканье кошки. Высокое и пронзительное звучание детского крика обусловлено анатомическими особенностями строения гортани при данном синдроме – узостью ее просвета, небольшим надгортанником, необычной складчатостью слизистой оболочки, мягкой консистенцией хрящей. Некоторые авторы считают, что специфический крик имеет центральное происхождение и не связан с недоразвитием гортани. Примерно у трети детей «кошачий крик» исчезает к 2-м годам, у остальных остается на всю жизнь.
Фенотип детей с синдромом «кошачьего крика» отличается преобладанием лицевой части черепа над мозговой, лунообразным лицом, гипертелоризмом, антимонголоидным разрезом глаз, эпикантом, деформацией ушных раковин, плоской спинкой носа, короткой шеей с крыловидными складками. При обследовании у детей выявляется микроцефалия, мышечная гипотония, снижение рефлексов, нарушение сосания и глотания. В неонатальном периоде может развиваться инспираторный стридор и цианоз.
Другие клинические проявления синдрома «кошачьего крика» могут значительно варьироваться по своему сочетанию у отдельных больных. Со стороны зрительной системы нередко обнаруживается врожденная катаракта, близорукость, косоглазие, атрофия зрительного нерва. Изменения со стороны костно-мышечной системы проявляются синдактилией стоп, врожденным вывихом бедра, косолапостью, плоскостопием, клинодактилией V пальца кисти, сколиозом, диастазом прямых мышц живота, паховыми и пупочными грыжами. Частыми спутниками синдрома «кошачьего крика» являются нарушения прикуса, «готическое» нёбо, микрогения, расщелины нёба и верхней губы, расщепление язычка.
У многих пациентов наблюдаются врожденные пороки сердца (ДМЖП, ДМПП, открытый артериальный поток, тетрада Фалло), пороки развития почек (гидронефроз, подковообразная почка), крипторхизм, гипоспадия. Реже отмечается мегаколон, запоры, кишечная непроходимость. Дерматоглифическими признаками синдрома «кошачьего крика» могут служить одна ладонная складка, поперечные складки сгибания и др.
Поведение детей характеризуется гиперактивностью, однообразными движениями, склонностью к агрессии и истерикам. Детям с синдромом «кошачьего крика» свойственна глубокая умственная отсталость в степени имбецильности и идиотии, грубое системное недоразвитие речи, выраженное отставание в моторном и физическом развитии.
Половая и репродуктивная функции у лиц с синдромом «кошачьего крика» обычно не страдают. Иногда у женщин выявляется двурогая матка, у мужчин – уменьшение размеров тестикул, однако сперматогенез существенно не нарушен, как, например, при синдроме Клайнфельтера.
Лечение синдрома «кошачьего крика»
Специфического лечения данного хромосомного заболевания в настоящее время не существует. Для стимуляции психомоторного развития под наблюдением детского невролога проводятся курсы медикаментозной терапии, массажа, физиотерапии, ЛФК. Дети с синдромом «кошачьего крика» нуждаются в помощи психологов, дефектологов, логопедов.
Врожденные пороки сердца при синдроме «кошачьего крика» часто требуют хирургической коррекции, поэтому детям необходима консультация кардиохирурга, проведение ЭхоКГ и других необходимых исследований. Дети с патологией мочевыделительной системы должны находиться под наблюдением детского нефролога и периодически проходить комплекс необходимых обследований (УЗИ почек, общий анализ мочи, биохимическое исследование крови и мочи и др.).
Симптомы
Развитию мультисистемного воспалительного синдрома у детей предшествует ОРВИ или подтвержденный COVID-19. Главным клиническим симптомом является фебрильная лихорадка (присутствует у 100% заболевших), которая не купируется в течение 1-2 недель или возобновляется после кажущегося выздоровления. Типичен абдоминальный болевой синдром, сопровождающийся диареей или рвотой. Об этом сообщают от 60 до 97% пациентов. Клиническая картина имитирует вирусный гастроэнтерит, а в некоторых случаях ‒ острый аппендицит.
Другими патогномоничными признаками служат полиморфная (макулезная, макулопапулезная) сыпь (50-76%). У 30 до 50% детей с мультисистемным воспалительным синдромом отмечаются признаки угнетения ЦНС: вялость, цефалгия, судороги, спутанное сознание. Могут возникать загрудинные боли, артериальная гипотензия, вазодилататорный шок. Респираторные нарушения – одышка, тахипноэ – наблюдаются у 20-65% детей.
Часто развивается двусторонний конъюнктивит, склерит, хейлит, лимфаденопатия. Менее распространенными проявлениями выступают отечность кистей и стоп, боль в горле.
Патогенез
Патофизиология мультисистемного воспалительного синдрома во многом остается неясной. По всей видимости, в его основе лежит вирус-индуцированная гипериммунная реакция. ДМВС рассматривается как аналог цитокинового шторма у взрослых. В его патогенезе прослеживаются механизмы, присущие синдрому Кавасаки, синдрому активации макрофагов и синдрому высвобождения цитокинов.
Важнейшую роль в патогенезе играет активация Т-лимфоцитов, гиперпродукция провоспалительных цитокинов (ФНО-α, интерлейкинов 1, 2, 6, 8, 10, ГМ-КСФ), отложение иммунных комплексов в сосудистой стенке. Эти механизмы обусловливают развитие мультисистемного воспалительного ответа и объясняют большинство клинико-лабораторных признаков синдрома: лихорадку, гиперферритинемию, коагулопатию, повышение маркеров воспаления.
Патологоанатомическая картина ДМВС характеризуется развитием иммунного некротизирующего васкулита, гиперкоагуляционного синдрома с гемофагоцитозом, поражением ЦНС, ССС, ЖКТ, кожи и слизистых.
Общие сведения
Общая доля детей в структуре заболеваемости COVID-19 составляет 1-1,7%. 90% из них переносит новую коронавирусную инфекцию бессимптомно, в легкой или среднетяжелой форме. Вместе с тем, у отдельных пациентов младше 18 лет на фоне ковид-инфекции развивается выраженная гипервоспалительная реакция и полиорганные нарушения. Этот феномен получил название «детского мультисистемного воспалительного синдрома» (ДМВС, МВС у детей). Всего описано свыше 600 случаев ДМВС. Большинство наблюдений зафиксировано в Великобритании, Франции и США.

Shaken baby syndrome что это

статью в формате PDF
КРАТКОВРЕМЕННЫЕ ОДНОСТОРОННИЕ НЕВРАЛГИЧЕСКИЕ ГОЛОВНЫЕ БОЛИ (SUNCT и SUNA)

Наряду с широко распространенными первичными формами головной боли, мигренью и головной болью напряжения в практике невролога могут встретиться и более редкие синдромы, относящиеся, по международной классификации головных болей, к группе тригеминальных вегетативных цефалгий (ТВЦ). Специфическая характеристика большинства синдромов, входящих в ТВЦ, - сочетание односторонней головной и/или лицевой боли с симптомами парасимпатической активации (слезотечение, покраснение конъюнктивы, заложенность носа или ринорея) и дисфункцией симпатической нервной системы (частичный синдром Горнера).
Самая редкая разновидность ТВЦ, встречающаяся менее чем у 0,1 - 0,4% популяции, - это кратковременные односторонние невралгические приступы головной боли (КОНГБ), которые проявляются повторяющимися приступами односторонней лицевой боли в зоне тригеминальной иннервации и вегетативными симптомами. Известно, что КОНГБ чаще встречается у мужчин (соотношение частоты болей у мужчин и женщин 4,3:1) и обычно начинается между 40 и 70 годами. Более детальные сведения об эпидемиологии КОНГБ отсутствуют в связи с низкой распространенностью и малочисленностью описаний этих синдромов. Обобщенные диагностические критерии синдромов, входящих в КОНГБ, представлены в таблице:

Самая известная разновидность КОНГБ - это кратковременные односторонние невралгические приступы головной боли с инъецированием конъюнктивы и слезотечением (КОНКС [англ. - Shortlasting Unilateral Neuralgiform Headache Attacks with Conjunctival Injection and Tearing, SUNCT]). Распространенность КОНКС составляет 6,6 на 100 тысяч, а заболеваемость - 1,2 случая на 100 тысяч человек в год).
КОНКС (SUNCT) впервые был описан норвежским исследователем О. Sjaastad еще в 1978 году. Тем не менее нозологическая самостоятельность этого синдрома длительное время считалась дискуссионной из-за недостаточно четких диагностических критериев, этот синдром не вошел в перечень головных и лицевых болей Международной классификации первого издания 1988 года. Только в 2003 году Международная классификация головных болей второго издания включила КОНКС-синдром в третью часть классификации в рубрику «Кластерная головная боль и другие тригеминальные вегетативные (автономные) цефалгии», были сформулированы диагностические критерии. В МКГБ 3-бета (2013) феноменология КОНКС-синдрома существенно дополнилась. Согласно определениям этой классификации КОНГБ включают в себя два подтипа: [ 1 ] КОНКС (Short-lasting Unilateral Neuralgiform headache attacks with Conjunctival injection and Tearing, SUNCT); и [ 2 ] кратковременные односторонние невралгические приступы головной боли с краниальными вегетативными симптомами (Short-lasting Unilateral Neuralgiform headache attacks with cranial Autonomic symptoms, SUNA). При этом для каждого подтипа КОНГБ имеются диагностические критерии. SUNCT: [A] приступы, отвечающие критериям КОНГБ; [B] сочетание инъекции конъюнктивы и слезотечения. SUNA: [A] приступы, отвечающие критериям КОНГБ; [B] отмечается только один симптом (инъецирование конъюнктивы, слезотечение) или нет ни одного из этих симптомов. Эти синдромы могут иметь эпизодический или хронический характер. При эпизодической форме (SUNCT и SUNA) приступы возникающие в срок от семи дней до одного года, с ремиссиями, свободными от боли, продолжительностью от одного месяца и более. При хронической форме (SUNCT и SUNA) приступы возникают без периода ремиссии или с ремиссиями продолжительностью менее одного месяца в течение как минимум одного года.

SUNCT может быть одним из вариантов SUNA (требуется дальнейшее изучение). Между тем в настоящее время каждый из них все еще классифицируется как отдельный подтип КОНГБ.
Этиология и патогенез КОНКС не изучены. Предполагают, что, как и при пучковой (кластерной) головной бои (ПГБ), происхождение болевых эпизодов при КОНКС связано с дисфункцией супрахиазмального ядра гипоталамуса. Однако для КОНКС не характерны типичные для ПГБ периодичность («пучковость») и возникновение приступов во время ночного сна. Локальные вегетативные симптомы, как и при ПГБ, возможно, объясняются связью гипоталамуса с парасимпатическими ядрами и симпатическими нейронами спинного мозга и ствола и служат проявлениями гипоталамической активации. Механизмы многократного повторения кратковременных болевых эпизодов при КОНКС неизвестны.

Клинические особенности КОНКС-синдрома. Болевые эпизоды могут возникать в любое время суток, однако чаще во время бодрствования (лишь у 1 - 2% пациентов отмечено преобладание ночных приступов). Большинство приступов развивается спонтанно, однако описаны случаи их провокации жеванием, кашлем, усиленным носовым дыханием, прикосновением к векам или области лба, движениями шеи (повороты, наклоны головы вперед и назад), а также употреблением холодных продуктов и напитков. Боль во время приступа локализуется в области иннервации первой ветви тройничного нерва: вокруг глаза, в области виска и лба строго с одной стороны; возможна иррадиация боли в область носа, щеки и нёба на болевой стороне; чрезвычайно редко боль может возникать с обеих сторон. Боль носит невралгический характер, описывается как острая колющая, прокалывающая, по типу прохождения электрического тока, жгучая (в некоторых атаках боль может становиться непереносимой, поэтому пациенты не могут находиться в состоянии покоя, а пребывают в состоянии двигательного возбуждения). Обычно боль начинается внезапно и в течение нескольких секунд (2 - 3 с) достигает максимальной интенсивности и внезапно прекращается. В 23% случаев боль описывается пациентами как непереносимая, лишь у 14% пациентов боль умеренного характера. Продолжительность приступов при SUNCT-синдроме значительно варьирует. Анализ данных литературы показывает, что при SUNCT-синдроме могут встречаться три основных по длительности типа приступов: относительно короткие (длятся менее 5 с или от 5 до 120 с), длительные (более 120 с) и продолжительные интермиттирующие с наличием фоновой головной боли. Как правило, болевой приступ продолжительнее, чем при тригеминальной невралгии, но короче, чем при КГБ. Частота приступов колеблется от 1 до 200 в сутки (в среднем около 60). Описан случай с 30 атаками в течение часа. По данным клинических описаний, болевые эпизоды могут иметь различный характер и продолжительность: от единичных колющих болей и серий «проколов» до более длительных приступов с множественными «прокалывающими» болями; между приступами боль полностью не проходит, нередко остаются ноющие ощущения в области верхних или нижних зубов. Практически в 100% случаев атака при SUNCT-синдроме сопровождается коньюктивальной инъецированностью, в 95% слезотечением, в 55% ринореей, в 44% заложенностью носа, в 30% случаев отечностью век. Коньюктивальная инъецированность обычно возникает быстро, через 1 - 2 с после возникновения боли, а ринорея, наоборот, носит отсроченный характер и возникает относительно поздно в течение приступа. КОНКС характеризуется ремиттирующим течением; болевой период может длиться от нескольких дней до нескольких месяцев; у большинства пациентов обострение возникает 1 - 2 раза в год (т.е. у большинства больных отмечается эпизодическое течение). Ремиссии имеют продолжительность от нескольких месяцев до нескольких лет. [ . ] С течением времени наблюдается тенденция к утяжелению и учащению болевых эпизодов.

Обратите внимание! Поскольку в литературе описаны симптоматические случаи КОНКС, ясно, что диагностика этого синдрома требует обязательного проведения нейровизуализационных исследований. Симптомы, схожие с КОНКС, отмечены при патологии задней черепной ямки (артериовенозная мальформация мостомозжечкового угла, кавернозная ангиома моста, инфаркт ствола, базилярная импрессия, краниостеноз), а также при поражениях, вовлекающих гипофиз. Кроме того, приступы КОНКС приходится дифференцировать с невралгией тройничного нерва с вовлечением офтальмической ветви, а также с пароксизмальной гемикранией континуа.

В настоящее время не существует данных исследований, которые бы позволяли обсуждать специфическую терапию КОНКС-синдрома. На данный момент рекомендации по фармакологическому лечению КОНКС-синдрома основаны на руководствах по лечению ТВЦ, учитывая существующие общие механизмы всей этой группы цефалгий:

Подробнее о КОНКС в следующих источниках:
статья «Кратковременные односторонние невралгические головные боли с инъецированием конъюнктивы и слезотечением (синдром КОНКС): успешное лечение топираматом» Осипова В.В., Афанасьева О.И.; ФГАОУ ВО «Первый Московский государственный медицинский университет имени И.М. Сеченова» МЗ РФ, Москва; ГБУЗ «Научно-практический психоневрологический центр» ДЗМ, Москва; ГБУЗ «Городская клиническая больница имени В.М. Буянова» ДЗМ, Москва (Неврологический журнал, №3, 2017) [читать];
статья «SUNCT-синдром. От клинической диагностики к возможности эффективной терапии» Е.В. Пархоменко, С.Э. Нартов, А.Н. Баринов, Д.Ю. Карпов; ФГБОУ ВО «Алтайский государственный медицинский университет» МЗ РФ, г. Барнаул; ООО «Нейроклиника Карпова», г. Барнаул; ФГБОУ ВО «Первый Московский государственный медицинский университет имени И.М. Сеченова» МЗ РФ, Москва (журнал «Медицинский алфавит» №2, 2017) [читать];
статья «Невралгическая головная боль с вегетативными проявлениями» М.Ю. Максимова, М.А. Пирадов, Е.Т. Cуанова, Н.А. Синева; ФГБНУ «Научный центр неврологии», Москва; Московский государственный медико-стоматологический университет, Москва (Журнал неврологии и психиатрии, №11, 2015) [читать]
Прогноз и профилактика
Мультисистемный воспалительный синдром, ассоциированный с SARS-CoV-2, следует рассматривать как тяжелое проявление или осложнение COVID-19 у детей. Он требует проведения интенсивной терапии, может сопровождаться тяжелыми и смертельно опасными ближайшими и отдаленными последствиями. Летальность составляет 0,5-1%. Профилактике МВС способствует катамнестическое наблюдение детей, больных и контактных по COVID-19. Особенного внимания и более тщательного обследования заслуживают пациенты, входящие в группы риска. Вопрос о назначении профилактической антикоагулянтной терапии детям с COVID-19 остается дискутабельным.
Диагностика синдрома «кошачьего крика»
Если в семье уже имелись случаи хромосомных заболеваний, еще на этапе планирования беременности будущим родителям рекомендуется посетить генетика и пройти генетическое тестирование. В процессе беременности наличие у плода синдрома «кошачьего крика» может быть заподозрено на основании результатов ультразвукового пренатального скрининга. В этом случае для окончательного подтверждения хромосомной аномалии рекомендуется проведение инвазивной пренатальной диагностики (амниоцентеза, биопсии ворсин хориона или кордоцентеза) и непосредственного анализа генетического материала плода.
После рождения предварительный диагноз синдрома «кошачьего крика» устанавливается неонатологом на основании типичных диагностических признаков (характерного плача, фенотипических черт, множественных стигм дизэмбриогенеза). Для подтверждения хромосомной патологии проводится цитогенетическое исследование.
Учитывая наличие у детей с синдромом «кошачьего крика» множественных аномалий развития, необходимо, чтобы в первые дни жизни новорожденные были осмотрены детским кардиологом, детским офтальмологом, детским урологом, детским ортопедом и другими специалистами.
Причины синдрома «кошачьего крика»
Развитие синдрома «кошачьего крика» связано с потерей фрагмента 5-ой хромосомы, а, следовательно, генетической информации, хранящейся на этом участке. В 85-90% случаев делеция короткого плеча образуется в результате случайной мутации, в 10-15% наследуется от родителей, являющихся носителями сбалансированной транслокации.
Наиболее частыми цитогенетическими вариантами хромосомной аберрации служат утрата одной трети или половины длины короткого плеча 5-ой хромосомы. Потеря меньшего участка или всего плеча встречается исключительно редко. При этом для степени выраженности клинической картины синдрома «кошачьего крика» важен не размер утерянного фрагмента, а отсутствие конкретного участка хромосомы. Так, при потере небольшого участка хромосомы в области 5p15.2 развиваются все клинические признаки синдрома, кроме кошачьего крика; критическим для возникновения характерного крика является выпадение участка хромосомы в области 5p15.3.
Наряду с простой делецией, могут встречаться другие цитогенетические вариации синдрома «кошачьего крика»: мозаицизм, кольцевая 5-я хромосома с делецией участка короткого плеча, реципрокная транслокация короткого плеча 5-ой хромосомы на другую хромосому.
Непосредственной причиной мутации могут выступать различные повреждающие факторы, воздействующие на половые клетки родителей либо на зиготу (алкоголь, курение, наркотические вещества, ионизирующая радиация, лекарственные препараты, химикаты и пр.). Вероятность появления ребенка с синдромом «кошачьего крика» выше в семьях, где уже рождались дети с подобным заболеванием.
Лечение мультисистемного воспалительного синдрома
Терапия МВС проводится в отделении детском ОРИТ. Решение по тактике ведения таких пациентов принимается коллегиально с обязательным участием врача-ревматолога. Основные принципы терапии мультисистемного воспалительного синдрома изложены в «Методических рекомендациях по лечению COVID-19 у детей» от 03.07.2020 г. Они включают:
- Оксигенотерапию. Кислородозависимым пациентам могут нуждаться в неинвазивной респираторной поддержке или подключении к ИВЛ. В особо тяжелых случаях прибегают к ЭКМО.
- Иммуномодулирующую терапию. В качестве терапии первой линии рекомендовано использование ГКС (дексаметазон, метилпреднизолон) в возрастных дозах. Также показано внутривенное введение человеческого нормального иммуноглобулина. При неэффективности ГКС применяются препараты моноклональных антител (тоцилизумаб, канакинумаб).
- Антикоагулянтную и антиагрегантную терапию. Из антикоагулянтов применяются низкомолекулярные гепарины, ингибиторы фактора свертывания Xа. При коронарите показан прием низких доз ацетилсалициловой кислоты.
- Антибиотикотерапию. Противомикробные средства необходимы в случае наслоения вторичной бактериальной инфекции. Выбор ЛС зависит от вида возбудителя и тяжести инфекционного процесса.
- Симптоматическую терапию. При гипертермии применяются физические средства охлаждения (воздушные ванны, обтирание спиртом), антипиретики в форме сиропа, таблеток, ректальных суппозиториев. При кашле с вязкой мокротой назначаются муколитики, при бронхообструкции – бронходилататоры.
Читайте также:

