Mgs какая среда
Обновлено: 04.07.2024
MgS соль среднего основания и слабой кислоты гидролиз по аниону
1 стадия
MgS+2H2o=Mg(OH)2+Mg(HS)2
Полное ионное уравнение
Mg(2+)+S(2-)+2H2O=MgOH(+)+Mg(HS)2
Вторая стадия гидролиза
Молекулярное уравнение
mg(HS)2+2H2O=Mg(OH)2+2H2S
Полное ионное уравнение
Mg(2+)+2HS(-)+2H2O=MgOH(+)+OH(-)+2H2S
Т к в результате гидролиза образовались гидроксид ионы ОН (-) то р-р щелочной РН больше 7
NaBr бромид натрия соль сильного основания и сильной кислоты гидролиз не протекает
CrCI3- хлорид хрома соль слабого основания и сильной кислоты гидролиз по катиону
Первая стадия гидролиза
СrCI3+H2O=CrOHCI2+HCI
Полное ионное уравнение
cr(3+)+3CI(-)+HOH=CrOH(2+)+2CI(-)+H(+)+CI(-$
Краткое ионное уравнение
Сr(3+)+HOH =CrOH(2+)+H(+)
Вторая стадия гидролиза
Молекулярное уравнение
CrOHCI2+H2O=Cr(OH)2CI+HCI
Полное ионное уравнение
CrOH(2+)+2CI(-)+H2O=Cr(OH)2(+)+CI(-)+H(+)+CI(-)
Краткое ионное уравнение
CrOH(2+)+H2O=Cr(OH)2(+)+H(+)
Третья стадия гидролиза
Молекулярное уравнение
Cr(OH)2+H2O=Cr(OH)3+HCI
Полное ионное уравнение
Cr(OH)2(+)+CI(-)+H2O=Cr(OH)3+H(+)+CI(-)
Краткое ионное уравнение
Сr(OH)2+H2O=Cr(OH)3+H(+)
Т к в результате гидролиза образовались ионаH то среда кислая рh меньше7
K2SiO3 силикат калия соль сильного основания и слабой кислоты гидролиз по катиону
K2SiO3 + HOH=KOH+KHSiO3
2K(+)+SiO3(2-)+HOH=K(+)+OH(-)+K(+)+HSiO3(-)
siO3(2-)+HOH+OH(-)+HSiO3(-)
Реакция среды щелочная т к образовались ионы OH(-)
Если рассматривать гидролиз солей, то гидролизу подвергаются средние и кислые соли, в образовании которых участвовали сильная кислота и слабое основание (FeSO4, ZnCl2), слабая кислота и сильное основание (NaCO3, CaSO3), слабая кислота и слабое основание ((NH4)2CO3, BeSiO3). Если соль получена путем взаимодействия сильных кислоты и основания (NaCl, K2SO4) реакция гидролиза не протекает.
Примеры решения задач
Zn 2+ + HOH ↔ ZnOH + + H + .
Соль сульфид магния (MgS) образована сильным основанием – гидроксидом магния и слабой кислотой – сероводородной. Подвергается гидролизу по аниону. Уравнение номер 4.
Соль ацетат аммония (CH3COONH4) образована слабым основанием – гидроксидом аммония и слабой кислотой – уксусной. Подвергается гидролизу по катиону и аниону. Уравнение номер 2.
Соль нитрит лития (LiNO2) образована сильным основанием – гидроксидом лития и слабой кислотой – азотистой. Подвергается гидролизу по аниону. Уравнение номер 1.
| Задание | Сульфид магния растворили в 200 мл 3%-ной соляной кислоты (плотность 1,23 г/мл). Какая масса хлорида магния при этом образовалась? |
| Решение | Запишем уравнение реакции взаимодействия сульфида магния и соляной кислоты: |
Рассчитаем массу раствора соляной кислоты:
msolution(HCl)= Vsolution (HCl)×ρ =200×1,23 =246г.
Найдем массу растворенного вещества соляной кислоты:
msolute(HCl) = 246× 3/100% = 7,38 г.
Тогда, количество вещества соляной кислоты будет равно (молярная масса – 36,5 г/моль):
Гидролиз (греч. hydor - вода и lysis - разрушение) - процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает "слабое" - это правило вам очень пригодится.

- NaCl - производное основания NaOH и кислоты HCl
- KNO3 - производное основания KOH и кислоты HNO3
- CuSO4 - производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 - производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 - производное основания Ca(OH)2 и кислоты HNO2
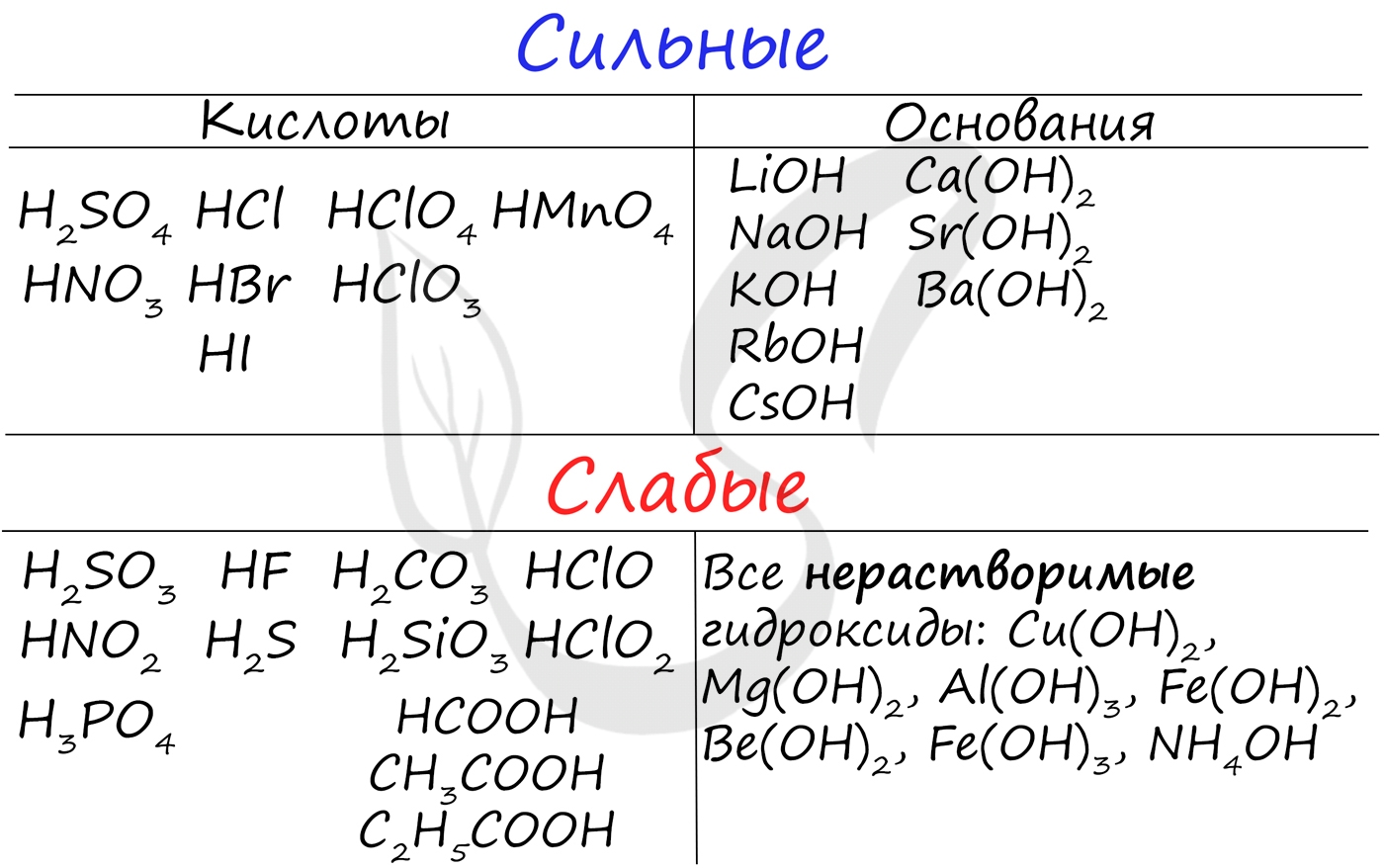
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие - сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт - она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем ;-)
По катиону, по аниону или нет гидролиза?
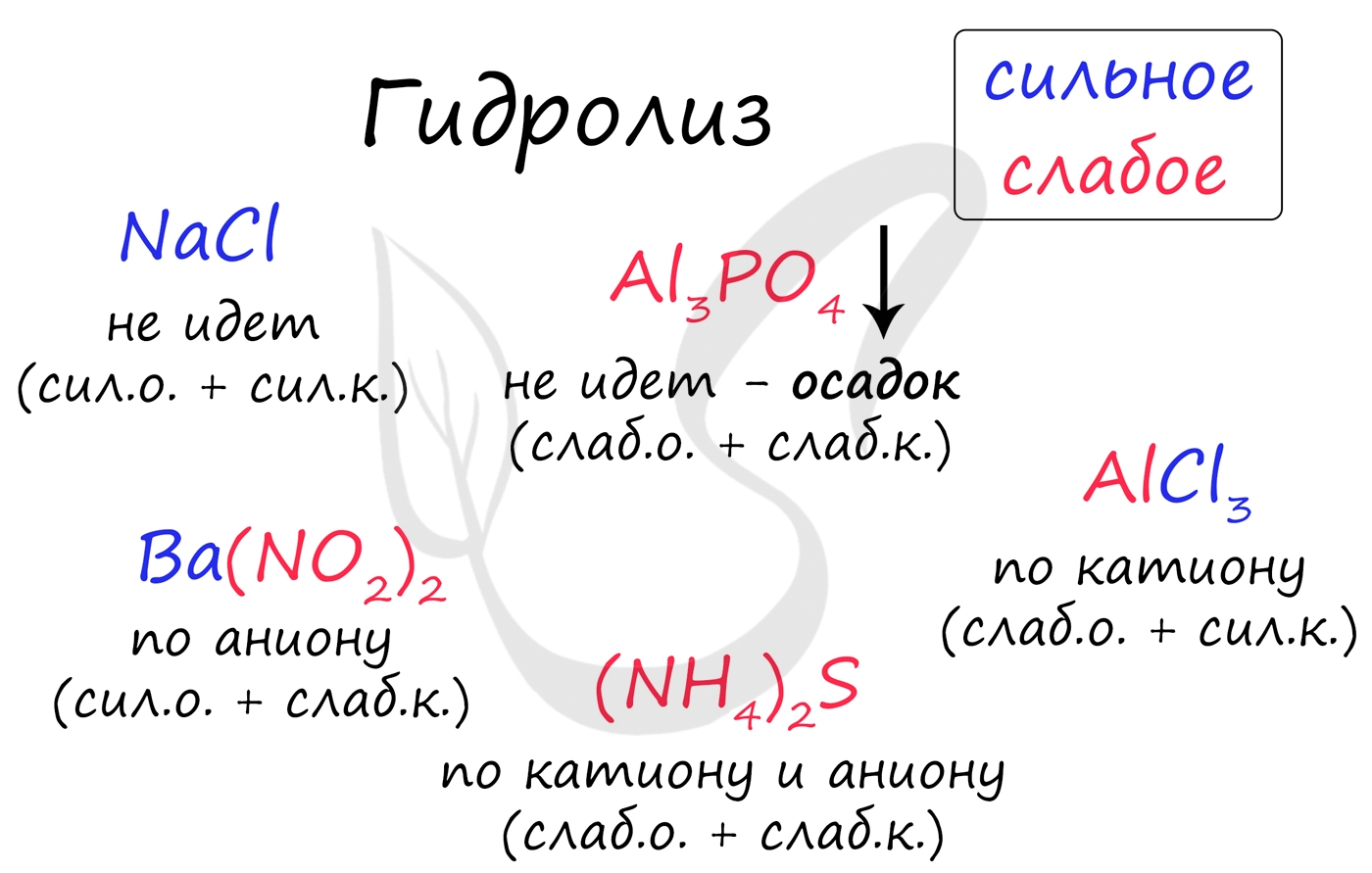
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты - гидролиза не происходит. Примеры: NaCl, KBr, CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4, FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз разрушает слабое, в данном случае - катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4 + и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2 не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.

Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора - нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда - кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
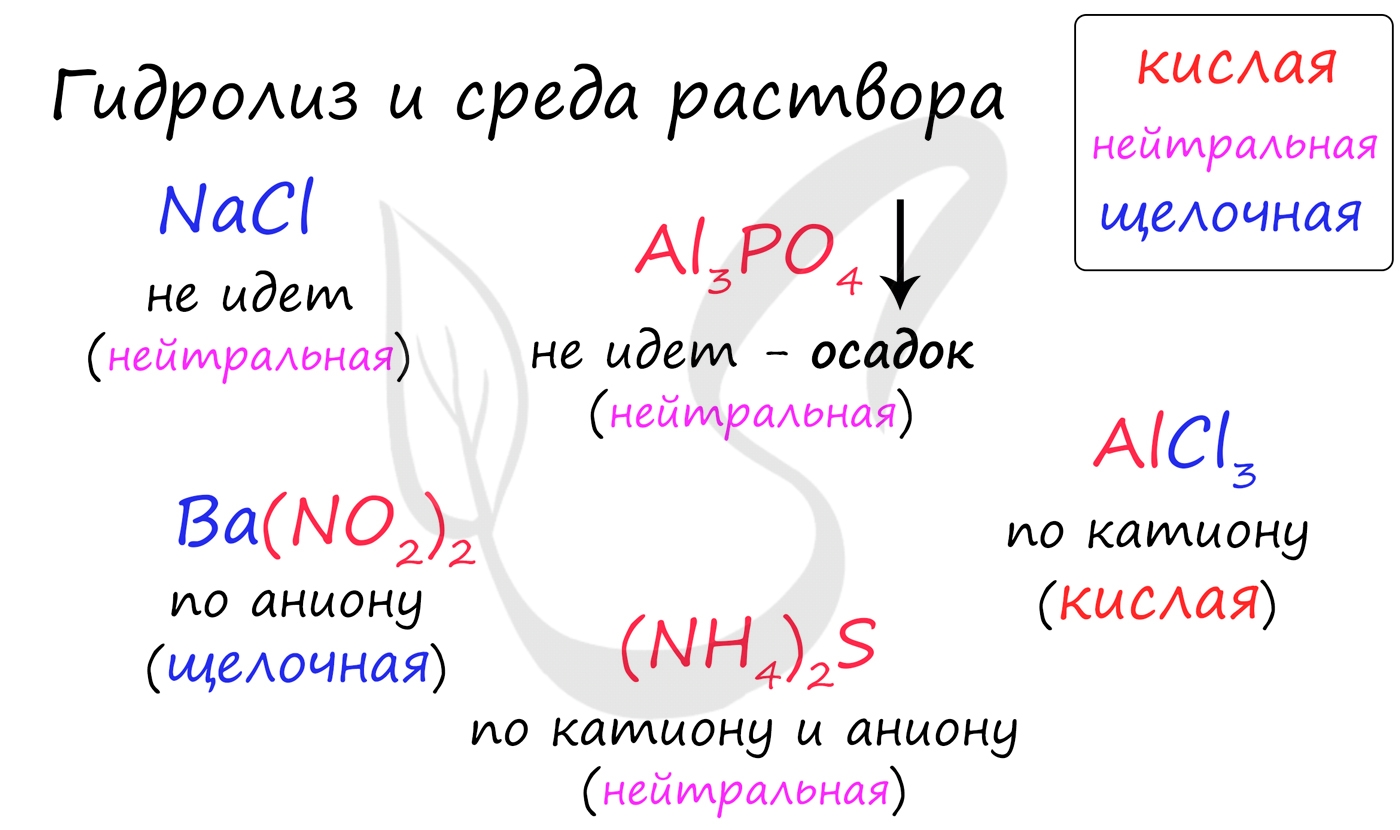
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
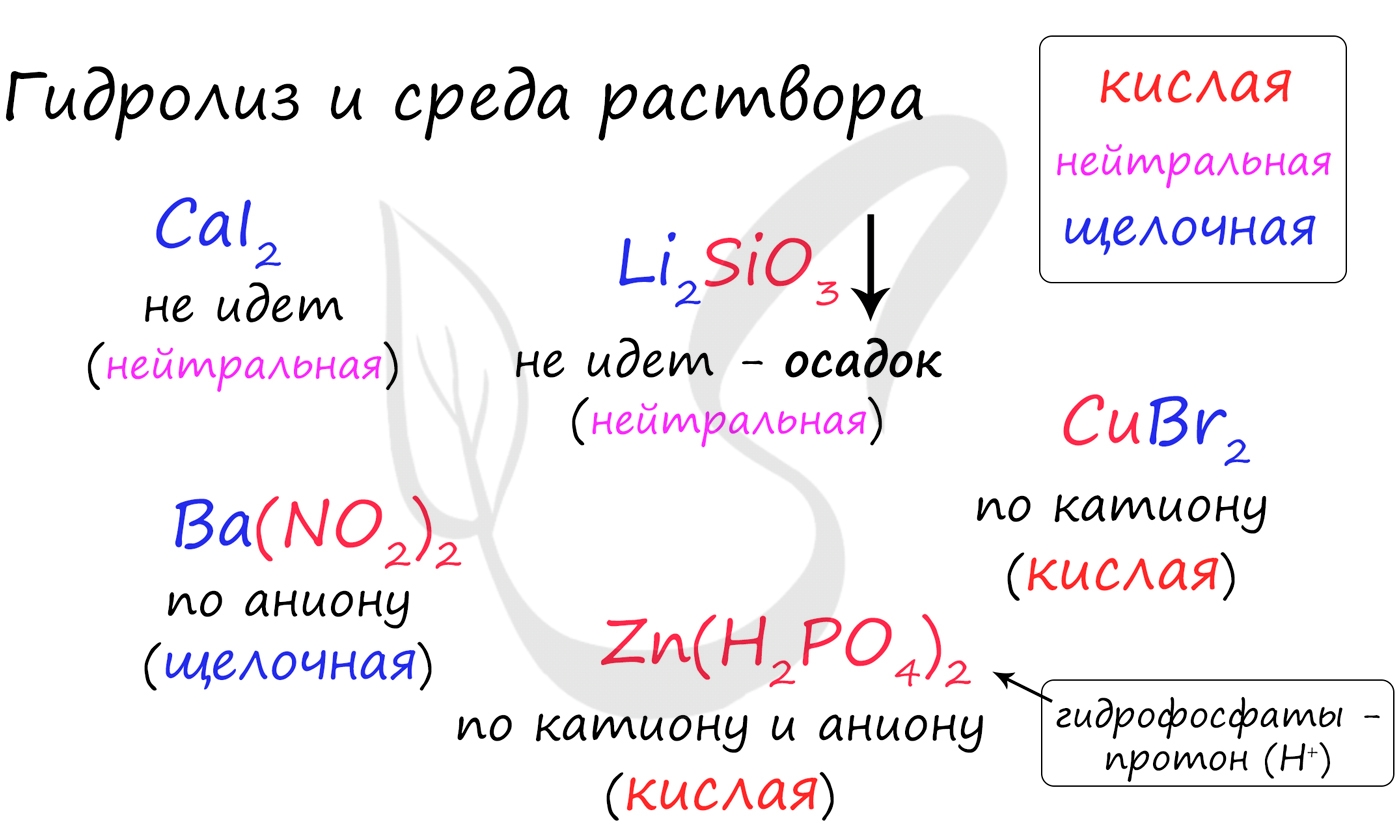
С целью запутать в заданиях часто бывают даны синонимы. Так "среду раствора" могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
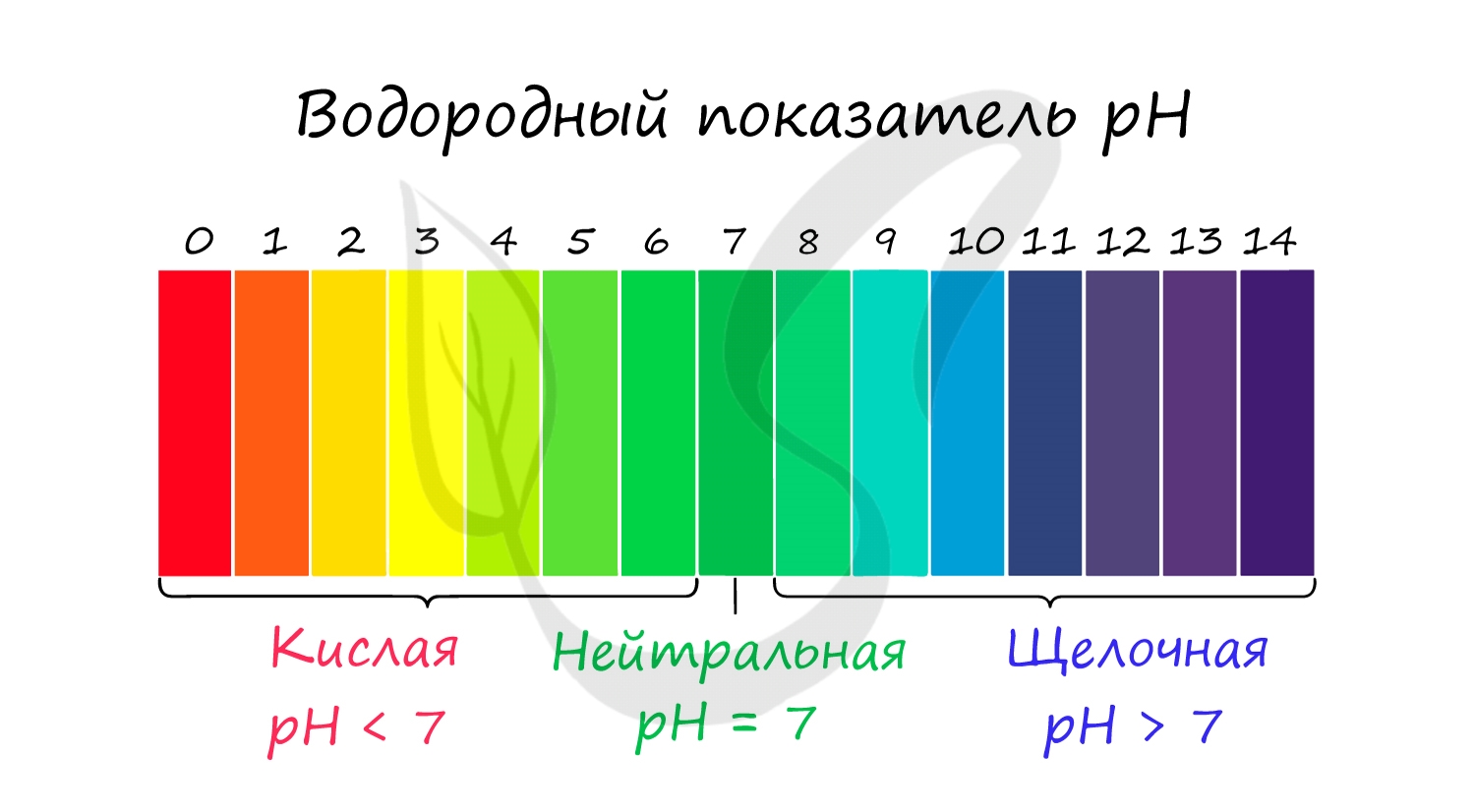
Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 - кислой (pH
Гидролиз сульфида магния
Гидролизуется по аниону. Характер среды – щелочной. Теоретически возможна вторая ступень. Уравнения гидролиза выглядит следующим образом:
MgS ↔ Mg 2+ + S 2- (диссоциация соли);
2MgS +2H2O ↔ Mg(HS)2 + Mg(OH)2↓ (уравнение в молекулярной форме).
Mg(HS)2 + 2H2O ↔ 2H2S↑ + Mg(OH)2↓ (уравнение в молекулярной форме).
Типы гидролиза
Выделяют несколько типов гидролиза, среди которых наибольшее значение имеют:
а) гидролиз по аниону
Этот тип гидролиза характерен только для неорганических и органических солей, в образовании которых участвовали слабая кислота и сильное основание, например, по аниону гидролизуются метасиликат натрия (Na2SiO3), формиат натрия (HCOONa), ацетат калия (CH3COOK), сульфит кальция (CaSO3) и т.д.
CH3COOK + H2O↔ CH3COOH + KOH (молекулярное уравнение).
б) гидролиз по катиону
Этот тип гидролиза также характерен только для неорганических солей, в образовании которых участвовали сильная кислота и слабое основание, например, по катиону гидролизуются хлорид железа (III) (FeCl3), сульфат меди (II) (CuSO4), нитрат бериллия (Be(NO3)2) и т.д.
Be 2+ +H2O ↔ BeOH + + H + (сокращенное ионное уравнение);
Теоретически возможна вторая ступень гидролиза:
BeOH + + H2O ↔ Be(OH)2 + H + (сокращенное ионное уравнение);
Наличие ионов H + свидетельствует о кислом характере среды.
в) гидролиз и по катиону, и по аниону
Этот тип гидролиза характерен только для неорганических и органических солей, в образовании которых участвовали слабая кислота и слабое основание. Например, по катиону и аниону гидролизуются сульфит аммония (NH4SO3), сульфид железа (II) (FeS), нитрит меди (II) (Cu(NO2)2) и т.д.
FeS ↔ Fe 2+ + S 2- (диссоциация соли);
г) щелочной гидролиз
Этот тип гидролиза характерен только органических соединений.Вещество гидролизуется под действием щелочей. Рассмотрим более подробно на примере галогенпроизводных:

д) кислотный гидролиз

е) ферментативный гидролиз
Такому типу гидролизу подвергают биополимеры, например, белки и углеводы: на одной из стадий гидролиза для более быстрого расщепления высокомолекулярных соединений в реакционную смесь вводят энзимы (ферменты).
Молярная масса – 56г/моль. Представляет собой вещество белого цвета с кристаллической структурой.
Читайте также:

