Изменение фактора xiii снижена вероятность тромбозов инсульта
Обновлено: 05.07.2024
Комплексное исследование генетических факторов риска развития нарушений в системе свертывания крови и фолатном цикле.
Различные изменения в генах системы гемостаза и цикла обмена фолатов предрасполагают к развитию большого числа патологических состояний: инфаркты, инсульты, тромбоэмболии, кровотечения, патология беременности и родов, осложнения послеоперационного периода и т.д.
Профиль включает в себя исследование основных полиморфизмов в генах системы гемостаза и фолатного цикла:
- F2 c.*97G>A (20210 G>A; rs1799963),
- F5 c.1601G>A (Arg534Gln; 1691 G>A; rs6025),
- MTHFR c.665C>T (Ala222Val; 677 C>T; rs1801133),
- MTHFR c.1286A>C (Glu429Ala; 1298 A>C; rs1801131),
- MTR c.2756A>G (Asp919Gly; rs1805087),
- MTRR c.66A>G (Ile22Met; rs1801394),
- F13 с.103G>T (I63Т; rs5985),
- FGB c.-467G>A (-455 G>А; rs1800790),
- ITGA2 c.759C>T (Phe253Phe, 807 C>T; rs1126643),
- ITGB3 c.176T>C (Leu59Pro; 1565 T>C; rs5918),
- F7 c.1238G>A (Arg353Gln; 10976 G>A; rs6046),
- PAI-1 (SERPINE1) –675 5G>4G (rs1799889).
Ген F2 кодирует аминокислотную последовательность белка протромбина. Полиморфизм F2 c.*97G>A приводит к повышенной экспрессии гена. Клинически неблагоприятный вариант полиморфизма (c.*97A) наследуется по аутосомно-доминантному типу. Наличие полиморфизма F2 c.*97G>A в гомозиготной или гетерозиготной форме значительно (в 3 и более раз, а на фоне курения - в 40 и более раз) увеличивает риск возникновения венозных тромбозов, в том числе тромбозов сосудов мозга и сердца, особенно в молодом возрасте. У пациентов-носителей данного полиморфизма повышен риск развития тромбоэмболий после хирургических вмешательств. Приём оральных контрацептивов у данной группы лиц также увеличивает риск тромбозов (относительный риск развития тромбофилии и венозной тромбоэмболии у гетерозиготных носительниц полиморфизма c.*97G>A возрастает в 16 раз).
Ген F5 кодирует аминокислотную последовательность белка проакцелерина - коагуляционного фактора 5. Нуклеотидная замена c.1601G>A («мутация Лейден») приводит к аминокислотной замене аргинина на глутамин в позиции 534, что придает устойчивость активной форме проакцелерина. Клинически это проявляется рецидивирующими венозными тромбозами и тромбоэмболиями. Наличие полиморфизма в гомозиготной или гетерозиготной форме значительно (в 3 и более раз, а на фоне заместительной гормонотерапии или приема оральных контрацептивов - в 30 и более раз) увеличивает риск венозных тромбозов. Риск инфаркта миокарда увеличивается в 2 и более раз, риск развития патологии беременности (прерывание беременности, преэклампсия, хроническая плацентарная недостаточность и синдром задержки роста плода) увеличивается в 3 и более раз.
Также, пациенты, являющиеся одновременно носителями полиморфизма c.*97G>A гена протромбина и «мутации Лейден», еще в большей степени подвержены риску развития тромбозов и тромбоэмболий.
Ген MTHFR кодирует аминокислотную последовательность фермента метилентетрагидрофолатредуктазы, играющего ключевую роль в метаболизме фолиевой кислоты. Полиморфизм c.665C>T гена MTHFR связан с заменой нуклеотида цитозина (С) на тимин (Т), что приводит к аминокислотной замене аланина на валин в позиции 222. Вариант c.665Т связан с четырьмя группами мультифакториальных заболеваний: сердечно-сосудистыми, дефектами развития плода, колоректальной аденомой и раком молочной железы и яичников. У женщин с генотипом c.665Т/Т дефицит фолиевой кислоты во время беременности может приводить к порокам развития плода, в том числе незаращению нервной трубки. Неблагоприятное воздействие варианта c.665Т- зависит от внешних факторов: низкого содержания в пище фолатов, курения, приема алкоголя. Сочетание генотипа c.665Т/Т и папилломавирусной инфекции увеличивает риск цервикальной дисплазии. Назначение препаратов фолиевой кислоты может значительно снизить негативное влияние данного варианта полиморфизма.
Полиморфизм MTHFR c.1286A>C связан с точечной заменой нуклеотида аденина (А) на цитозин (С), что приводит к замене аминокислотного остатка глутаминовой кислоты на аланин в позиции 429, относящейся к регулирующей области молекулы фермента. При наличии данного полиморфизма отмечается снижение активности фермента MTHFR. Это снижение обычно не сопровождается изменением уровня гомоцистеина в плазме крови у носителей дикого варианта полиморфизма c.665C>T, однако сочетание аллельного варианта* c.1286C с аллелем c.665T приводит к снижению уровня фолиевой кислоты и соответствует по своему эффекту гомозиготному состоянию MTHFR c.665Т/T. При этом риск развития дефектов нервной трубки повышается в 2 раза. Жизнеспособность плодов, имеющих одновременно оба полиморфных варианта, также снижена.
Ген MTR кодирует аминокислотную последовательность фермента метионин синтазы. Полиморфизм c.2756A>G связан с аминокислотной заменой (аспарагиновой кислоты на глицин) в молекуле фермента. В результате этой замены функциональная активность фермента изменяется, что приводит к повышению риска формирования пороков развития у плода. Влияние полиморфизма усугубляется повышенным уровнем гомоцистеина.
Ген MTRR кодирует аминокислотную последовательность фермента редуктазы метионинсинтазы. Полиморфизм c.66A>G связан с аминокислотной заменой в молекуле фермента. В результате этой замены функциональная активность фермента снижается, что приводит к повышению риска развития дефектов нервной трубки у плода. Влияние полиморфизма усугубляется дефицитом витамина В12. При сочетании полиморфизма c.66A>G гена MTRR с полиморфизмом c.665C>T в гене MTHFR риск spina bifida увеличивается. Полиморфизм c.66A>G гена MTRR усиливает гипергомоцистеинемию, вызываемую полиморфизмом c.665C>T в гене MTHFR.
Ген фибриназы (F13) кодирует синтез трансглютаминазы, участвующей в стабилизации фибринового сгустка и в формировании соединительной ткани. Аллельные варианты с.103G/Т и с.103Т/Т приводят к снижению уровня трансглютаминазы с образованием сетчатой структуры фибрина с более тонкими волокнами, меньшими порами, и изменением характеристик проникновения, которое в сочетании с другими факторами риска ассоциируется с возможным риском внутричерепных кровоизлияний и кровотечений из внутренних органов, а также привычным невынашиванием беременности. При этом аллельный вариант с.103Т может выступать в роли протективного фактора в отношении инфаркта миокарда и венозных тромбозов.
Ген FGB кодирует β-цепь фибриногена, являющегося предшественником фибрина. Аллельный вариант c.-467А обусловливает усиленную транскрипцию гена и может приводить к увеличению уровня фибриногена в крови и повышению вероятности образования тромбов при наличии дополнительных факторов риска. Гетерозиготный вариант c.-467G/А связывают с повышенным риском ишемического инсульта и лакунарными инфарктами церебральных сосудов. Гомозиготный вариант c.-467A/А связывают с повышенным риском инфаркта миокарда.
Ген гликопротеина Gp1a (ITGA2) кодирует синтез альфа-2-субъединицы интегринов – специализированных рецепторов тромбоцитов. Аллельный вариант c.759Т вызывает изменение первичной структуры субъединицы и свойств рецепторов. При гетерозиготном (c.759C/T) варианте отмечается увеличение скорости адгезии тромбоцитов к коллагену I типа, что может приводить к повышенному риску тромбофилии, инфаркта миокарда и других сердечно-сосудистых заболеваний. Аллельный вариант c.759Т связывают со случаями резистентности к аспирину. Помимо этого, при гомозиготном (c.759Т/T) варианте значительно увеличивается количество рецепторов на поверхности тромбоцитов. В совокупности, при гомозиготном варианте данного полиморфизма значительно повышен риск тромбофилии, инфаркта миокарда и развития других острых эпизодов тромбообразования в возрасте до 50 лет, даже по сравнению с гетерозиготным вариантом.
Ген гликопротеина Gp3a (ITGB3) кодирует синтез бета-3 цепи интегринового комплекса GP2b\3a, участвующего в разнообразных межклеточных взаимодействиях (адгезии и сигнализации).
Аллельный вариант c.176С (гетерозигота c.176T/C) обусловливает повышенную адгезию тромбоцитов и может приводить к увеличению риска развития острого коронарного синдрома, а также связан с синдромом привычного невынашивания беременности. Гомозиготный вариант c.176С/C обусловливает повышенную адгезию тромбоцитов и может приводить к значительному увеличению риска развития острого коронарного синдрома в возрасте до 50 лет. У лиц с полиморфными аллельными вариантами часто отмечается пониженная эффективность аспирина.
Аллельный вариант c.1238A (гетерозигота c.1238G/A и гомозигота c.1238А/A) гена F7 приводит к понижению экспрессии гена и снижению уровня фактора 7 в крови, рассматривается как протективный маркёр в отношении развития тромбозов и инфаркта миокарда.
Ген ингибитора активатора плазминогена (PAI-1) кодирует белок-антагонист тканевого и урокиназного активатора плазминогена. Преобладающим в популяции вариантом исследуемого полиморфизма является гетерозиготный вариант -675 5G/4G. В связи с этим данный полиморфизм самостоятельного диагностического значения не имеет, эффект возможно оценить в сочетании с другими факторами предрасполагающими к развитию патологии (например в сочетании с FGB c.-467A). Аллельный вариант -675 4G сопровождается большей активностью гена, чем -675 5G, что обусловливает более высокую концентрацию PAI-1 и уменьшение активности противосвёртывающей системы. Гомозигота -675 4G/4G ассоциирована с повышением риска тромбообразования, преэклампсии, нарушением функции плаценты и самопроизвольного прерывания беременности.
*Примечание: иногда в научной литературе при описании однонуклеотидных замен, характерных для генных полиморфизмов, встречается термин "мутантный аллель". Это терминологическая неточность, так как в классической генетике термин "мутантный аллель" традиционно рассматривается как синоним термина "мутация". При мутациях, как известно, изменение структуры гена приводит к образованию (экспрессии) нефункциональных белков и к неизбежному развитию наследственного заболевания. При полиморфизмах изменение в структуре гена приводит лишь к появлению белков с немного изменёнными физико-химическими свойствами. Такие изменения, как известно, проявляют себя при воздействии на организм различных факторов внешней среды или при изменении функционального состояния организма человека. И только в таких ситуациях функционирование белков со структурными особенностями может, либо способствовать ускорению развития заболевания, либо, напротив, тормозить формирование патологических процессов. Поэтому, на наш взгляд, для разграничения изменений в генах столь очень похожих структурно, но приводящих к несоизмеримо разным последствиям для организма, корректнее в отношении генных полиморфизмов применять понятие "аллельный вариант гена", а не "мутантный аллель".
Специальной подготовки к исследованию не требуется.
- тромбофилические состояния в анамнезе у пациента и его родственников;
- тромбофилии во время беременности и в послеродовом периоде;
- длительный прием оральных контрацептивов;
- другие патологические состояния, предрасполагающие к развитию тромбозов и тромбоэмболий;
- выявление у родственников полиморфных аллельных вариантов в генах факторов свертывания крови и фолатного цикла;
- преэклампсия, преждевременная отслойка нормально расположенной плаценты, хроническая плацентарная недостаточность, синдром задержки роста плода, случаи мертворождения, привычное невынашивание беременности в анамнезе;
- беременность при повышенном риске рождения ребенка с пороками развития.
Интерпретация результатов исследований содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Отсутствие или наличие полиморфизма(ов) в гомо(гетеро)зиготной форме, предрасполагающего(их) к развитию нарушений фолатного цикла, гипокоагуляции, тромбозов, ишемической болезни сердца (ИБС).
Тип выдачи ответа - качественный, заключение врача-генетика на отдельном бланке.
*Заполнение «анкеты молекулярно-генетического исследования» необходимо для того, чтобы врач-генетик, на основании полученных результатов, во-первых, имел бы возможность выдать пациенту максимально полное заключение и, во-вторых, сформулировать для него конкретные индивидуальные рекомендации. ИНВИТРО гарантирует конфиденциальность и неразглашение предоставляемой пациентом информации в соответствии с законодательством Российской Федерации.
Комплексный генетический анализ, который позволяет определить риск тромбофилии. Он представляет собой молекулярно-генетическое исследование генов факторов свертываемости крови, тромбоцитарных рецепторов, фибринолиза, обмена фолиевой кислоты, изменение активности которых напрямую или опосредованно обуславливает склонность к повышенному тромбообразованию.
Какой биоматериал можно использовать для исследования?
Буккальный (щечный) эпителий, венозную кровь.
Как правильно подготовиться к исследованию?
Подготовки не требуется.
Подробнее об исследовании
В результате различных патологических процессов в сосудах могут образоваться тромбы, которые блокируют кровоток. Это самое частое и неблагоприятное проявление наследственной тромбофилии – повышенной склонности к тромбообразованию, связанной с определенными генетическими дефектами. Она может приводить к развитию артериальных и венозных тромбозов, которые в свою очередь зачастую являются причиной инфаркта миокарда, ишемической болезни сердца, инсульта, тромбоэмболии легочной артерии и др.
В систему гемостаза входят факторы свертывающей и противосвертывающей систем крови. В нормальном состоянии они находятся в равновесии и обеспечивают физиологические свойства крови, не допуская повышенного тромбообразования или, наоборот, кровоточивости. Но при воздействии внешних или внутренних факторов это равновесие может нарушаться.
В развитии наследственной тромбофилии, как правило, принимают участие гены факторов свертывания крови и фибринолиза, а также гены ферментов, контролирующих обмен фолиевой кислоты. Нарушения в этом обмене могут привести к тромботическим и атеросклеротическим поражениям сосудов (через повышение уровня гомоцистеина в крови).
Наиболее значимым нарушением, ведущим к тромбофилии, является мутация в гене фактора свертываемости 5 (F5), ее еще называют Лейденской. Она проявляется устойчивостью фактора 5 к активированному протеину С и увеличением скорости образования тромбина, в результате чего и происходит усиление процессов свертываемости крови. Также важную роль в развитии тромбофилии играет мутация в гене протромбина (F2), связанная с повышением уровня синтеза данного фактора свертываемости. При наличии этих мутаций риск тромбозов значительно возрастает, особенно за счет провоцирующих факторов: приема оральных контрацептивов, избыточного веса, гиподинамии и т. д.
У носительниц таких мутаций высока вероятность неблагоприятного течения беременности, например невынашивания беременности, задержки внутриутробного развития плода.
Предрасположенность к тромбозам может быть также обусловлена мутацией гена FGB, кодирующего бета-субъединицу фибриногена (генетический маркер FGB (-455GA). Результатом является повышение синтеза фибриногена, вследствие чего возрастает риск периферического и коронарного тромбоза, риск тромбоэмболических осложнений во время беременности, при родах и в послеродовом периоде.
Среди факторов, повышающих риск развития тромбоза, очень важны гены тромбоцитарных рецепторов. В данном исследовании проводится анализ генетического маркера гена тромбоцитарного рецептора к коллагену (ITGA2 807 C>T) и фибриногену (ITGB3 1565T>C). При дефекте гена рецептора к коллагену усиливается прилипание тромбоцитов к эндотелию сосудов и к друг к другу, что ведет к повышенному тромбообразованию. При анализе генетического маркера ITGB3 1565T>C возможно выявить эффективность или неэффективность антиагрегантной терапии аспирином. При нарушениях, обусловленных мутациями в этих генах, повышается риск тромбозов, инфаркта миокарда, ишемического инсульта.
С тромбофилией могут быть связаны не только нарушения свертывающей системы крови, но и мутации генов фибринолитической системы. Генетический маркер SERPINE1 (-675 5G>4G) – ингибитор активатора плазминогена – основного компонента антисвертывающей системы крови. Неблагоприятный вариант этого маркера приводит к ослаблению фибринолитической активности крови и, как следствие, повышает риск сосудистых осложнений, различных тромбоэмболий. Мутация гена SERPINE1 также отмечается при некоторых осложнениях беременности (невынашивание беременности, задержка развития плода).
Кроме мутаций факторов свертывающей и противосвертывающей систем, как значимую причину тромбофилии рассматривают повышенный уровень гомоцистеина. При чрезмерном накоплении он оказывает токсическое действие на эндотелий сосудов, поражает сосудистую стенку. В месте повреждения образуются тромбы, там же может осесть избыточный холестерин. Эти процессы приводят к закупориванию сосудов. Избыточное содержание гомоцистеина (гипергомоцистеинемия) увеличивает вероятность развития тромбозов в кровеносных сосудах (как в артериях, так и в венах). Одной из причин повышения уровня гомоцистеина является снижение активности ферментов, обеспечивающих его обмен (в исследование включен ген MTHFR). Помимо генетического риска развития гипергомоцистеинемии и ассоциированных с ней заболеваний, наличие изменений в данном гене позволяет определить предрасположенность и к неблагоприятному течению беременности (фетоплацентарной недостаточности, незаращению нервной трубки и другим осложнениям для плода). При изменениях в фолатном цикле в качестве профилактики назначаются фолиевая кислота и витамины В6, В12. Продолжительность терапии и дозировка препаратов может определяться на основании генотипа, уровня гомоцистеина и особенностей сопутствующих факторов риска у пациента.
Заподозрить наследственную предрасположенность к тромбофилии возможно при семейной и/или личной истории тромботических заболеваний (тромбоз глубоких вен, варикозная болезнь и др.) и также в акушерской практике – при тромбоэмболических осложнениях у женщин во время беременности, в послеродовом периоде.
Комплексное молекулярно-генетическое исследование позволяет оценить генетический риск тробофилии. Зная о генетической предрасположенности можно предотвратить своевременными профилактическими мероприятиями развитие сердечно-сосудистых нарушений..
Факторы риска развития тромбофилии:
- постельный режим (более 3 суток), длительная иммобилизация, долгие статические нагрузки, в том числе связанные с работой, малоподвижный образ жизни;
- применение пероральных контрацептивов, содержащих эстрогены;
- избыточная масса тела;
- венозные тромбоэмболические осложнения в анамнезе;
- катетер в центральной вене;
- обезвоживание;
- хирургические вмешательства;
- травма;
- курение;
- онкологические заболевания;
- беременность;
- сопутствующие сердечно-сосудистые заболевания, злокачественные новообразования.
Когда назначается исследование?
- При наличии тромбоэмболии в семейном анамнезе.
- При наличии тромбоза в анамнезе.
- При тромбозе в возрасте до 50 лет, повторных тромбозах.
- В случае тромбоза в любом возрасте в сочетании с отягощенным семейным анамнезом по тромбоэмболии (тромбоэмболия лёгочной артерии), в том числе при тромбозах других локализаций (сосудов мозга, портальных вен).
- При тромбозе без очевидных факторов риска в возрасте старше 50 лет.
- В случае применения гормональных контрацептивов или заместительной гормональной терапии у женщин: 1) имеющих тромбозы в анамнезе, 2) у родственников 1-й степени родства которых были тромбозы или наследственная тромбофилия.
- При осложненном акушерском анамнезе (невынашивании беременности, фетоплацентарной недостаточности, тромбозах во время беременности и в раннем послеродовом периоде и др.).
- При планировании беременности женщинами, страдающими тромбозами (или в случае тромбоза у их родственников 1-й степени родства).
- При таких условиях высокого риска, как полостные оперативные вмешательства, длительная иммобилизация, постоянные статические нагрузки, малоподвижный образ жизни.
- При сердечно-сосудистых заболеваниях в семейном анамнезе (случаи ранних инфарктов и инсультов).
- При оценке риска тромботических осложнений у больных со злокачественными новообразованиями.
Что означают результаты?
По результатам комплексного исследования 10 значимых генетических маркеров выдается заключение врача-генетика, которое позволит оценить риск тромбофилии, спрогнозировать развитие таких заболеваний как тромбоз, тромбоэмболия, инфаркт, или вероятность осложнений, связанных с нарушением гемостаза, при беременности, выбрать направления оптимальной профилактики, а при уже имеющихся клинических проявлениях детально разобраться в их причинах.
Генетические маркеры
Также рекомендуется
Литература
- Venous thromboembolism, thrombophilia, antithrombotic therapy, and pregnancy. American College of Chest Physicians evidence-based clinical practice guidelines 8th edition. American College of Chest Physicians – Medical Specialty Society. 2001 January.
- Gohil R. et al., The genetics of venous thromboembolism. A meta-analysis involving
Маркер связан с характером функционирования фактора XIIIA системы свертываемости крови. Исследуется для выявления генетической предрасположенности к инфаркту миокарда, тромбоэмболии.
Название гена – F13A1
OMIM 134570
Локализация гена на хромосоме – 6p25.1
Функция гена
Ген F13A1 кодирует А-субъединицу свертывающего фактора XIII (F13A1, субъединица А1) – белка, ответственного за конечную стадию в каскаде свертывания крови.
Генетический маркер G103T
Участок гена F13A1, в котором происходит замена нуклеотида гуанина (G) на тимин (Т) в позиции 103, обозначается как генетический маркер G103T. Следовательно, изменяются и биохимические свойства фермента, в котором аминокислота валин замещается на лейцин в позиции 34 аминокислотной последовательности белка.
Возможные генотипы
Частота встречаемости в популяции
Частота встречаемости аллеля T в европейской популяции составляет 23 %.
Ассоциация маркера с заболеваниями
Описание
Система гемостаза представляет собой совокупность биохимических процессов, обеспечивающих жидкое состояние крови, поддержание её нормальных реологических свойств (вязкости), предупреждение и остановку кровотечений. В нее входят факторы свёртывающей, естественной противосвертывающей и фибринолитической систем крови. В норме процессы в ней уравновешены, что поддерживает жидкое состояние крови. Смещение этого равновесия вследствие внутренних или внешних факторов может повышать риск кровотечений и тромбообразования.
Особое внимание при оценке риска тромбоэмболии и инфаркта миокарда уделяется генам коагуляционных (свертывающих) факторов крови 7 и 13 (F7, F13), изменения в которых в большинстве случаев направлены на обеспечение защитного эффекта. Снижение активности данных факторов способствует уменьшению тромбообразования.
Ген F13А1 кодирует А-субъединицу (F13A1, субъединица А-1) фактора XIII – белка, участвующего в процессе свертывания крови. Фактор XIII (F13), состоящий из двух А-субъединиц, имеющих каталитическую активность, и двух В-субъединиц, представляет собой плазматический гликопротеин, циркулирующий в плазме крови в комплексе с белком фибриногеном. При активации системы свертывания крови F13 подвергается расщеплению ферментом тромбином (фактором свертывания крови II, F2) в точке между аминокислотами аргинином и глицином, расположенными в положениях 37 и 38 аминокислотной последовательности. Кофактором в данной реакции являются ионы кальция. Активированный белок F13a катализирует «сшивание» мономеров фибрина, образуя связи между аминокислотами в положениях гамма-глутамил-эпсилон-лизин, что ведет к формированию фибрина-полимера. Фибрин – основа сгустка крови, он стабилизирует тромб, завершая процесс свертывания крови.
Изменения в гене F13A1 в большинстве случаев снижают риск развития патологий, связанных с повышенным тромбообразованием. Участок, в котором происходит замена нуклеотида гуанина (G) на тимин (Т) в позиции 103, обозначается как генетический маркер G103T. Вследствие замены нуклеотида валин замещается на лейцин в позиции 34 аминокислотной последовательности (V34L). Данный участок располагается в непосредственной близости от сайта взаимодействия F13 с тромбином. В результате замены преобразуются биохимические свойства белка F13, а именно его способность «сшивать» фибриновые мономеры, вследствие чего фибриновые сгустки получаются более тонкими.
Ассоциация маркера с инфарктом миокарда (ИМ)
Выявлено, что аллель T гена F13A1 встречается с меньшей частотой в группе пациентов с инфарктом миокарда по сравнению с контрольной группой.
При анализе статей, посвященных эффекту полиморфизма по маркеру G103T, связанного с риском развития инфаркта миокарда, исследователи оценили частотность аллелей в двух группах: у пациентов, перенесших инфаркт миокарда (3663 человека), и у контрольной группы (5080 здоровых людей). На основании проведенного анализа был доказан защитный эффект присутствия в генотипе аллеля Т.
Ассоциация маркера с венозным тромбозом
Генотип G/T обнаруживается у 38,6 % пациентов с глубоким венозным тромбозом и у 41,2 % здоровых людей, а генотип Т/Т у больных тромбозом выявлен всего в 1,6 % случаев, по сравнению с 9,6 % здоровых людей.
Таким образом, было показано, что гомозиготы по аллелю Т (генотип Т/Т) реже заболевают венозным тромбозом и вероятность инфаркта миокарда у них ниже.
Выявив генотип по данному маркеру, можно оценить генетическую предрасположенность к инфаркту миокарда, тромбоэмболии и провести соответствующие профилактические мероприятия.
Интерпретация результатов
Оценка генотипа по маркеру:
- G/G – «нормальная» активность белка F13
- G/T – активность белка F13 умеренно снижена
- T/T – активность белка F13 значительно снижена
Интерпретация результатов исследования должна проводиться врачом в комплексе с другими генетическими, анамнестическими, клиническими и лабораторными данными.
Исследование рекомендуется проводить в комплексе:
Важные замечания
Для данного маркера не существует понятия «норма» и «патология», т. к. исследуется полиморфизм гена.
Литература
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Тромбофилия: причины появления, симптомы, диагностика и способы лечения.
Определение
Тромбофилия – наследственные или приобретенные состояния, которые характеризуются чрезмерной склонностью организма к образованию тромбов в кровеносных сосудах. Под тромбообразованием понимают формирование сгустков крови в местах повреждения сосудистой стенки. Это физиологический процесс, который препятствует истечению крови в местах повреждений сосуда.
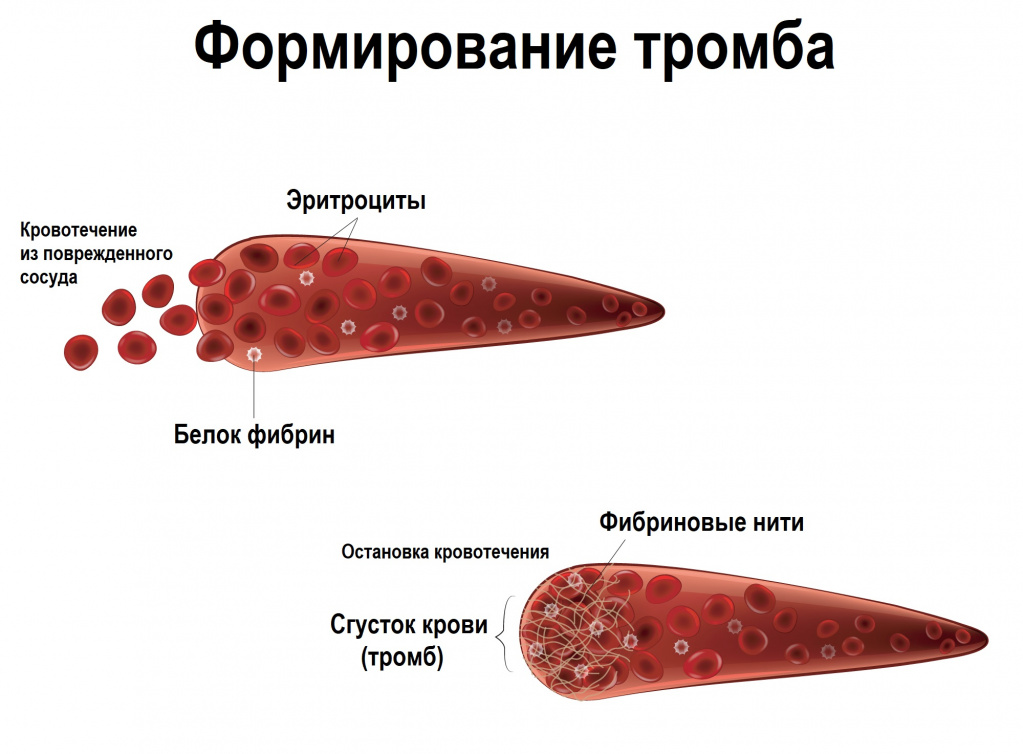
Однако если тромбообразование становится избыточным или само является причиной повреждения сосудистой стенки, речь идет о патологическом тромбозе. Таким образом, тромбоз – патология, вызванная аномальным формированием тромбов в кровеносных сосудах.
Причины появления тромбофилии
Поддержание крови в жидком состоянии и остановка кровотечения при повреждении сосуда реализуется посредством взаимодействия свертывающей, противосвертывающей и фибринолитической систем, имеющих множество составляющих.
В организме существует большое количество факторов свертывания, последовательно активирующихся при необходимости.
Таким образом, основной причиной тромбофилии становится дисбаланс свертывающих и противосвертывающих факторов крови, когда образование тромбов в сосудах происходит независимо от повреждения сосудистой стенки, а организм не может самостоятельно растворить их.
Классификация тромбофилии
В зависимости от этиологии (причины) тромбофилии подразделяются на две большие группы: врожденные (первичные) и приобретенные (вторичные).
К врожденным относят различные генетические дефекты, которые обуславливают предрасположенность организма к тромбозам. В этом случае риск патологического образования тромбов увеличивается при появлении дополнительных факторов тромбообразования (например, во время беременности и родов, у пациентов с выраженным ожирением, а также после травм, ожогов, длительной иммобилизации – неподвижности и др.).
Существуют подтвержденные данные о связи врожденной тромбофилии с дефицитом антитромбина III, протеина С и S, АПС-резистентностью, гомоцистинурией.
Приобретенная тромбофилия может быть связана с различными инфекционными, онкологическими заболеваниями.
Самой частой приобретенной тромбофилией иммунного генеза является антифосфолипидный синдром, возникающий при различных аутоиммунных и инфекционных заболеваниях и связанный с выработкой в организме определенных белков, т. н. антифосфолипидных антител.Синдром проявляется тромбозами вен и/или артерий, снижением числа тромбоцитов (тромбоцитопенией) и акушерско-гинекологической патологией – чаще всего привычным невынашиванием беременности.
Тромбофилия может быть одним из проявлений так называемого нефротического синдрома. При этом заболевании, наряду со снижением уровня альбумина в крови, выраженными отеками и повышением холестерина, имеется склонность к избыточному тромбообразованию.
Ряд заболеваний крови – истинная полицитемия, пароксизмальная ночная гемоглобинурия также могут проявляться образованием тромбов.
Ситуационная тромбофилия регистрируется при травмах, хирургических вмешательствах, особенно ортопедических, химиотерапии, приеме оральных контрацептивов, гормонально-заместительной терапии.В зависимости от локализации различают тромбозы артериальные (в артериях), микроциркуляторные (в капиллярном русле), венозные (в венах), смешанные (с поражением различных типов сосудов).
Симптомы тромбофилии
Клинические проявления тромбофилии различаются в зависимости от локализации тромбов.
Для венозных тромбозов, когда закупоривается сосуд, возвращающий кровь к сердцу, характерно нарушение оттока крови от органа, отеки, повышение кожной температуры в области тромбоза, чувство распирания, умеренной интенсивности давящая боль. Часто поражаются поверхностные или глубокие вены нижних конечностей. Поражение может быть односторонним.

При артериальных тромбозах, когда нарушается доставка крови к органу, может возникать резкая болезненность, чувство распирания, постоянные давящие боли, цианоз (синюшность), снижение температуры в области тромбообразования и прилежащих тканях. Так, при поражении артерий нижних конечностей возникает перемежающаяся хромота – боль в икроножных мышцах (реже в бедре, стопе), возникающая во время ходьбы, усиливающаяся при подъеме по лестнице и проходящая через несколько минут после остановки.
Клинические проявления тромбоза артерий головного мозга во многом зависят от локализации и диаметра пораженного сосуда, обратимости изменений, то есть от времени начала активной терапии. При инсульте наблюдается интенсивная головная боль, головокружение, нарушение сознания, речи, чувствительные и двигательные расстройства – онемение, слабость в руке или ноге с одной стороны.
Если предприняты незамедлительные меры по растворению тромба (тромболизис), человек может полностью восстановиться.Классической картиной при инфаркте миокарда являются интенсивные давящие боли за грудиной, иногда с иррадиацией в левую лопатку, левую руку; возможны резкая слабость, тошнота, рвота, страх смерти. При проведении тромболизиса возможен регресс симптоматики. Если же своевременное лечение не было проведено – участок сердечной мышцы замещается соединительной тканью (образуется рубец), он выключается из эффективного сокращения, из-за чего человек может хуже переносить физические нагрузки, могут появляться одышка, отеки нижних конечностей, как проявление сердечной недостаточности.
Диагностика тромбофилии
Диагноз подтверждается лабораторными и инструментальными методами. Основа диагностики – различные анализы крови.
Исследуют клинический анализ крови, отдельные параметры биохимического анализа крови – общий белок, альбумин, общий холестерин, креатинин и др.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Читайте также:

